9.19: Enlace de hidrógeno
- Page ID
- 70409
¿Cuál es la diferencia entre estas dos moléculas?
Una regla general aproximada es que los materiales de mayor peso molecular tienen puntos de ebullición más altos que sus contrapartes de menor peso molecular. Se necesita más energía para mover la molécula más grande del estado líquido al estado de vapor. Sin embargo, el amoníaco tiene un punto de ebullición\(-33.34^\text{o} \text{C}\) y un peso molecular de 17, mientras que el nitrógeno (peso molecular 28) tiene un punto de ebullición de\(-195.8^\text{o} \text{C}\). La molécula de amoníaco más ligera debe tener otros factores que influyan en sus propiedades físicas.
Enlace de hidrógeno
La fuerza de atracción entre las moléculas de agua es una interacción dipolo. Los átomos de hidrógeno están unidos al átomo de oxígeno altamente electronegativo (que también posee dos conjuntos de electrones de pares solitarios, lo que crea un enlace muy polar). El átomo de hidrógeno parcialmente positivo de una molécula es entonces atraído por el átomo de oxígeno de una molécula de agua cercana (ver figura abajo).
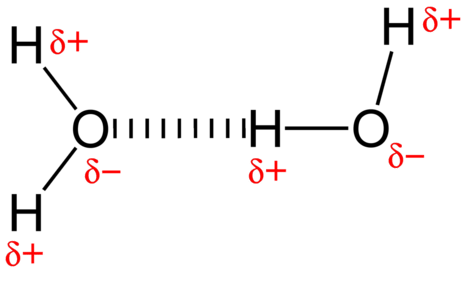
Un enlace de hidrógeno es una fuerza de atracción intermolecular en la que un átomo de hidrógeno que está unido covalentemente a un átomo pequeño y altamente electronegativo es atraído por un par solitario de electrones en un átomo en una molécula vecina. Los enlaces de hidrógeno son muy fuertes en comparación con otras interacciones dipolares. La fuerza de un enlace de hidrógeno típico es aproximadamente\(5\%\) de la de un enlace covalente.
Los enlaces de hidrógeno se producen solo en moléculas donde el hidrógeno está unido covalentemente a uno de tres elementos: flúor, oxígeno o nitrógeno. Estos tres elementos son tan electronegativos que retiran la mayor parte de la densidad electrónica en el enlace covalente con hidrógeno, dejando al\(\ce{H}\) átomo muy deficiente en electrones. El\(\ce{H}\) átomo casi actúa como un protón desnudo, dejándolo muy atraído por electrones de pares solitarios en un átomo cercano.
El enlace de hidrógeno que se produce en el agua conduce a algunas propiedades inusuales, pero muy importantes. La mayoría de los compuestos moleculares que tienen una masa similar al agua son gases a temperatura ambiente. Debido a los fuertes enlaces de hidrógeno, las moléculas de agua pueden permanecer condensadas en estado líquido. La siguiente figura muestra cómo la forma doblada, y dos átomos de hidrógeno por molécula, permiten que cada molécula de agua pueda unir hidrógeno a otras dos moléculas.
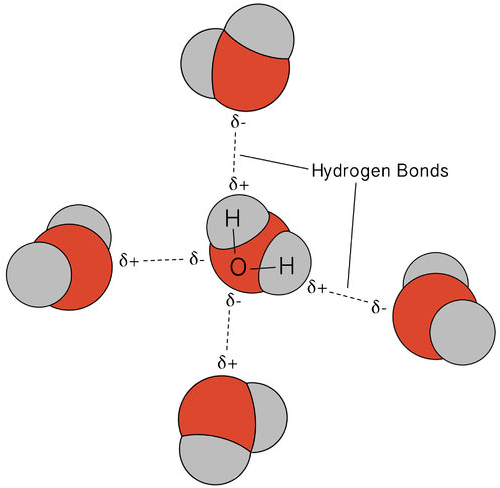
En estado líquido, los enlaces de hidrógeno del agua pueden romperse y reformarse a medida que las moléculas fluyen de un lugar a otro. Cuando se enfría el agua, las moléculas comienzan a disminuir la velocidad. Eventualmente, cuando el agua se congela en hielo, los enlaces de hidrógeno se vuelven permanentes y forman una red muy específica (ver figura a continuación).
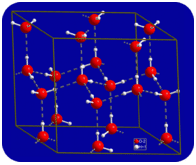
La forma doblada de las moléculas conduce a huecos en la red de enlaces de hidrógeno del hielo. El hielo tiene una propiedad muy inusual: su estado sólido es menos denso que su estado líquido. El hielo flota en el agua. Prácticamente todas las demás sustancias son más densas en estado sólido que en estado líquido. Los enlaces de hidrógeno juegan un papel biológico muy importante en las estructuras físicas de proteínas y ácidos nucleicos.
¿Por qué el agua forma gotitas? Pista: tiene que ver con la atracción entre las moléculas de agua. Conoce más (y mira cuántas gotas de agua puedes obtener un centavo puede contener) en esta simulación.
Resumen
- Los enlaces de hidrógeno se forman cuando un\(\ce{F}\) átomo\(\ce{H}\) unido a un\(\ce{N}\)\(\ce{O}\),, o interactúa con otro\(\ce{N}\)\(\ce{O}\), o\(\ce{F}\) átomo.
Revisar
- ¿Qué tan fuerte es un enlace de hidrógeno?
- ¿Qué sucede cuando H está unido covalentemente a N, O o F?
- ¿Cómo afecta la forma de la molécula de agua a las propiedades del hielo?

