9.18: Fuerzas Van der Waals
- Page ID
- 70370
¿Cómo mantenerlo fresco?
Los dispositivos de resonancia magnética (MRI) utilizan nitrógeno líquido para enfriar los imanes superconductores. El nitrógeno es un gas a temperatura ambiente y se licua a\(-195.8^\text{o} \text{C}\). Su vecino en la tabla periódica (oxígeno) hierve en\(-182.95^\text{o} \text{C}\). Las interacciones entre las moléculas de nitrógeno\(\left( \ce{N_2} \right)\) son más débiles, por lo que el punto de ebullición es menor. Las interacciones entre moléculas no polares dependen del grado de fluctuación electrónica dentro de la molécula.
Fuerzas Van der Waals
El primer tipo de fuerzas intermoleculares que consideramos son las fuerzas de van der Waals, después del químico holandés Johannes van der Waals (1837-1923). Las fuerzas de Van der Waals son la fuerza intermolecular más débil, y consisten en fuerzas dipolo-dipolo y fuerzas de dispersión.
Fuerzas dipolo-dipolo
Las fuerzas dipolo-dipolo son las fuerzas atractivas que ocurren entre las moléculas polares. Una molécula de cloruro de hidrógeno tiene un átomo de hidrógeno parcialmente positivo y un átomo de cloro parcialmente negativo. En una colección de muchas moléculas de cloruro de hidrógeno, las moléculas se alinearán de modo que las regiones cargadas opuestamente de las moléculas vecinas estén cerca una de la otra.
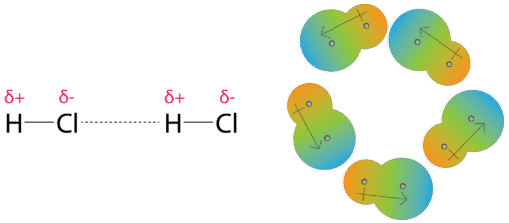
Las fuerzas dipolo-dipolo son similares en naturaleza a los enlaces iónicos, pero mucho más débiles.
Fuerzas de dispersión de Londres
Las fuerzas de dispersión también se consideran un tipo de fuerza de van der Waals y son las más débiles de todas las fuerzas intermoleculares. A menudo se les llama fuerzas de dispersión londinenses después de Fritz London (1900-1954), quien propuso por primera vez su existencia en 1930. Las fuerzas de dispersión de Londres son las fuerzas intermoleculares que ocurren entre los átomos, y entre las moléculas no polares como resultado del movimiento de los electrones.
La nube de electrones de un átomo de helio contiene dos electrones, que normalmente se puede esperar que estén igualmente distribuidos espacialmente alrededor del núcleo. Sin embargo, en cualquier momento dado la distribución electrónica puede ser desigual, dando como resultado un dipolo instantáneo. Este dipolo débil y temporal posteriormente influye en los átomos de helio vecinos a través de la atracción electrostática y la repulsión. Induce un dipolo en átomos de helio cercanos (ver figura abajo).
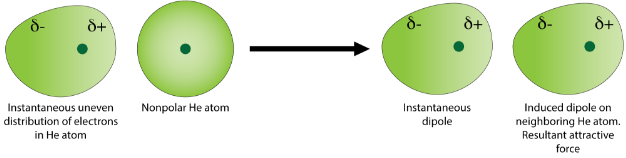
Los dipolos instantáneos e inducidos son débilmente atraídos entre sí. La fuerza de las fuerzas de dispersión aumenta a medida que aumenta el número de electrones en los átomos o moléculas no polares.
El grupo halógeno consta de cuatro elementos que toman la forma de moléculas diatómicas no polares. La siguiente tabla muestra una comparación de los puntos de fusión y ebullición para cada uno.
| Tabla\(\PageIndex{1}\): Puntos de fusión y ebullición de halógenos | ||||
|---|---|---|---|---|
| \ (\ PageIndex {1}\): Puntos de fusión y ebullición de los halógenos” style="vertical-align:middle; "> Molécula | Número Total de Electrones | Punto de fusión\(\left( ^\text{o} \text{C} \right)\) | Punto de ebullición\(\left( ^\text{o} \text{C} \right)\) | Estado físico a temperatura ambiente |
| \ (\ PageIndex {1}\): Puntos de fusión y ebullición de los halógenos” style="vertical-align:middle; ">\(\ce{F_2}\) | 18 | -220 | -188 | gas |
| \ (\ PageIndex {1}\): Puntos de fusión y ebullición de los halógenos” style="vertical-align:middle; ">\(\ce{Cl_2}\) | 34 | -102 | -34 | gas |
| \ (\ PageIndex {1}\): Puntos de fusión y ebullición de los halógenos” style="vertical-align:middle; ">\(\ce{Br_2}\) | 70 | -7 | 59 | líquido |
| \ (\ PageIndex {1}\): Puntos de fusión y ebullición de los halógenos” style="vertical-align:middle; ">\(\ce{I_2}\) | 106 | 114 | 184 | sólido |
Las fuerzas de dispersión son más fuertes para las moléculas de yodo porque tienen el mayor número de electrones. Las fuerzas relativamente más fuertes dan como resultado puntos de fusión y ebullición que son los más altos del grupo halógeno. Estas fuerzas son lo suficientemente fuertes como para mantener las moléculas de yodo juntas en estado sólido a temperatura ambiente. Las fuerzas de dispersión son progresivamente más débiles para el bromo, el cloruro y el flúor; esto se ilustra en sus puntos de fusión y ebullición constantemente más bajos. El bromo es un líquido a temperatura ambiente, mientras que el cloro y el flúor son gases cuyas moléculas están mucho más alejadas entre sí. Las fuerzas intermoleculares son casi inexistentes en el estado gaseoso, por lo que las fuerzas de dispersión en cloro y flúor solo se vuelven medibles a medida que la temperatura disminuye y se condensan en estado líquido.
¿Por qué el agua forma gotitas? Pista: tiene que ver con las interacciones entre las moléculas de agua. Prueba esta simulación para obtener más información.
Resumen
- Las fuerzas de Van der Waals son interacciones débiles entre moléculas que involucran dipolos.
- Las moléculas polares tienen interacciones dipolo-dipolo permanentes.
- Las moléculas no polares pueden interactuar por medio de las fuerzas de dispersión de Londres.
Revisar
- ¿Qué fuerzas atractivas se desarrollan entre las moléculas polares?
- ¿Qué crea las fuerzas de dispersión de Londres?
- ¿Las fuerzas de dispersión de Londres son permanentes o temporales?
- ¿Las fuerzas de dispersión para Cl 2 son más fuertes o más débiles que las del Br 2?

