9.21: Teoría del vínculo de valencia
- Page ID
- 70377
¿Qué pasa después?
Hemos visto que la vieja idea de anzuelo de átomos que conectan que tanto le gustaba a Demócrito simplemente no funciona. Los electrones no tienen pequeños ganchos sobre ellos, pero son la base para conectar átomos para formar moléculas. Has aprendido a escribir estructuras de punto de electrones de Lewis para moléculas y predecir su forma usando la teoría VSEPR. Ahora es el momento de aplicar estas habilidades para entender cómo se comportan los electrones en sus orbitales atómicos cuando se forma un enlace covalente.
Teoría de los bonos de valencia
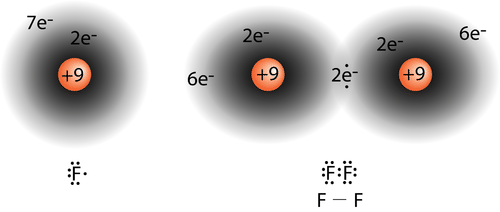
Se ha aprendido que se forma un enlace covalente cuando las nubes de electrones de dos átomos se superponen entre sí. En una\(\ce{H_2}\) molécula simple, el electrón único en cada átomo se vuelve atraído hacia el núcleo del otro átomo en la molécula a medida que los átomos se acercan. Finalmente se alcanza una distancia óptima, igual a la longitud del enlace, y la energía potencial alcanza un mínimo. Se ha formado un enlace covalente sencillo y estable entre los dos átomos de hidrógeno. Otros enlaces covalentes se forman de la misma manera que los electrones desapareados, cuando dos átomos “coinciden” para formar el enlace. En un átomo de flúor, hay un electrón desapareado en uno de los\(2p\) orbitales. Cuando se forma una\(\ce{F_2}\) molécula, los\(2p\) orbitales de cada uno de los dos átomos se superponen para producir el enlace\(\ce{F-F}\) covalente. Los orbitales superpuestos no tienen que ser del mismo tipo. En una molécula de\(\ce{HF}\), el\(1s\) orbital del átomo de hidrógeno se solapa con el\(2p\) orbital del\(2p\) orbital del átomo de flúor (ver figura a continuación).
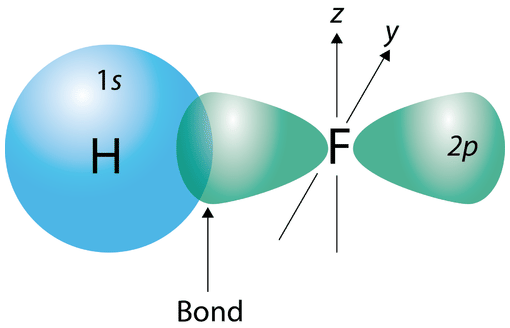
En esencia, cualquier enlace covalente resulta de la superposición de orbitales atómicos. Esta idea forma la base de una teoría mecánica cuántica llamada teoría del enlace de valencia (VB). En la teoría del enlace de valencia, se supone que los electrones en una molécula ocupan orbitales atómicos de los átomos individuales, y un enlace resulta de la superposición de esos orbitales.
Resumen
- Los electrones ocupan orbitales atómicos.
- Los enlaces covalentes son el resultado de la superposición de orbitales atómicos.
Revisar
- ¿Dónde están los electrones según la teoría del enlace de valencia?
- ¿Cómo se forman los enlaces covalentes?
- ¿Es necesario que los orbitales de los dos electrones involucrados en el enlace sean los mismos?