9.22: Orbitales Híbridos - sp³
- Page ID
- 70397
¿Reconoces esta planta?
Si estuviéramos caminando por la playa, las plantas que se muestran arriba se verían muy diferentes. Serían cortos y sobresaliendo de la arena. Cuando los vemos de esta manera, es posible que no los reconozcamos de inmediato como plantas de playa. A menudo, necesitamos mirar el mundo que nos rodea de diferentes maneras para entender mejor las cosas.
Orbitales Híbridos - sp 3
El esquema de unión descrito por la teoría de enlaces de valencia debe dar cuenta de geometrías moleculares según lo predicho por la teoría VSEPR. Para ello, debemos introducir el concepto de orbitales híbridos.
\(sp^3\)Hibridación
Desafortunadamente, la superposición de orbitales atómicos existentes (\(s\)\(p\),, etc.) no es suficiente para explicar algunos de los enlaces y geometrías moleculares que se observan. Considera el elemento carbono y la\(\left( \ce{CH_4} \right)\) molécula de metano. Un átomo de carbono tiene la configuración electrónica de\(1s^2 \: 2s^2 \: 2p^2\), lo que significa que tiene dos electrones desapareados en sus\(2p\) orbitales, como se muestra en la siguiente figura.
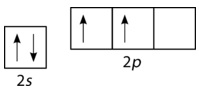
De acuerdo con la descripción de la teoría de los enlaces de valencia hasta el momento, se esperaría que el carbono formara solo dos enlaces, correspondientes a sus dos electrones desapareados. Sin embargo, el metano es una molécula común y estable, con cuatro\(\ce{C-H}\) enlaces equivalentes. Para dar cuenta de esto, uno de\(2s\) los electrones es promovido al\(2p\) orbital vacío (ver figura abajo).
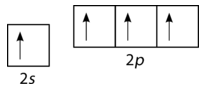
Ahora, cuatro bonos son posibles. La promoción del electrón “cuesta” una pequeña cantidad de energía, pero recordemos que el proceso de formación de enlaces va acompañado de una disminución de la energía. Los dos enlaces adicionales que ahora se pueden formar dan como resultado una menor energía general y, por lo tanto, una mayor estabilidad a la\(\ce{CH_4}\) molécula. El carbono normalmente forma cuatro enlaces en la mayoría de sus compuestos.
El número de enlaces es ahora correcto, pero la geometría es incorrecta. Los tres\(p\) orbitales, (\(p_x\),\(p_y\), y\(p_z\)), están orientados uno\(90^\text{o}\) con respecto al otro. Sin embargo, como se ve en la teoría de VSEPR, el ángulo de\(\ce{H-C-H}\) enlace observado en la\(\ce{CH_4}\) molécula tetraédrica es en realidad\(109.5^\text{o}\). Por lo tanto, la molécula de metano no puede representarse adecuadamente mediante el simple solapamiento de los\(2p\) orbitales\(2s\) y orbitales del carbono con los\(1s\) orbitales de cada átomo de hidrógeno.
Para explicar la unión en metano, es necesario introducir el concepto de hibridación y orbitales atómicos híbridos. La hibridación es la mezcla de los orbitales atómicos en un átomo para producir un conjunto de orbitales híbridos. Cuando se produce la hibridación, debe hacerlo como resultado de la mezcla de orbitales no equivalentes. En otras palabras,\(s\) y\(p\) los orbitales pueden hibridarse, pero\(p\) los orbitales no pueden hibridar con otros\(p\) orbitales. Los orbitales híbridos son los orbitales atómicos obtenidos cuando dos o más orbitales no equivalentes del mismo átomo se combinan en preparación para la formación de enlaces. En el caso actual del carbono, el\(2s\) orbital único se hibrida con los tres\(2p\) orbitales para formar un conjunto de cuatro orbitales híbridos, llamados\(sp^3\) híbridos (ver figura a continuación).
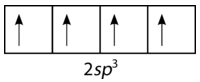
Los\(sp^3\) híbridos son todos equivalentes entre sí. Espacialmente, los orbitales híbridos apuntan hacia las cuatro esquinas de un tetraedro (ver figura abajo).
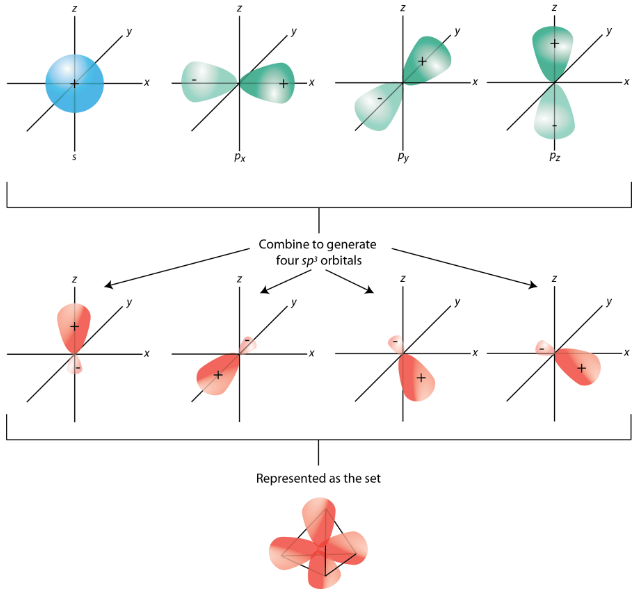
Resumen
- Los electrones se hibridan para formar enlaces covalentes.
- Orbitales no equivalentes se mezclan para formar orbitales híbridos.
Revisar
- ¿Por qué se espera que el carbono forme solo dos enlaces covalentes?
- ¿Cuántos enlaces covalentes forma realmente el carbono?
- ¿Qué tiene que pasar para permitir que el carbono forme cuatro enlaces?


