9.23: Orbitales Híbridos - sp y sp²
- Page ID
- 70412
¿Cómo se abre el círculo cerrado?
Romeo y Julieta fueron dos de los amantes ficticios más conocidos de todos los tiempos. Su abrazo permitió que ninguna otra persona fuera parte de ello, solo querían estar juntos. Se necesitó intervención externa para alejarlos unos de otros. Los electrones emparejados son similares a Romeo y Julieta. No se enlazan covalentemente hasta que no están apareados; entonces, pueden formar parte de una estructura química más grande.
sp Hibridación
Se predice que una\(\left( \ce{BeH_2} \right)\) molécula de hidruro de berilio es lineal por VSEPR. El átomo de berilio contiene todos los electrones emparejados y por lo tanto también debe someterse a hibridación. Uno de los\(2s\) electrones se promueve primero al\(2p_x\) orbital vacío (véase la figura a continuación).
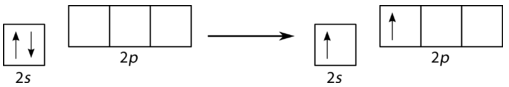
Ahora la hibridación se lleva a cabo sólo con orbitales ocupados, y el resultado es un par de orbitales\(sp\) híbridos. Los dos\(p\) orbitales restantes (\(p_y\)y\(p_z\)) no hibridan y permanecen desocupados (ver figura abajo).
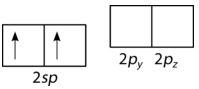
La geometría de los orbitales\(sp\) híbridos es lineal, con los lóbulos de los orbitales apuntando en direcciones opuestas a lo largo de un eje, definido arbitrariamente como el\(x\) eje -eje (ver figura abajo). Cada uno puede enlazarse con un\(1s\) orbital desde un átomo de hidrógeno para formar la\(\ce{BeH_2}\) molécula lineal.
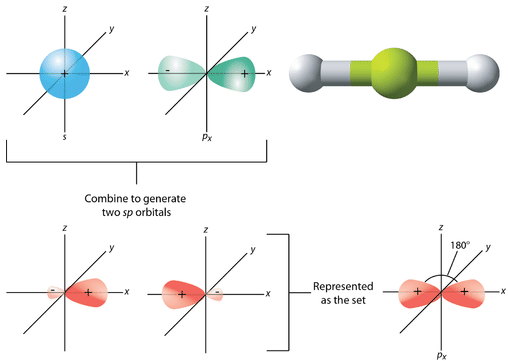
Otras moléculas cuya geometría de dominio electrónico es lineal y para las que es necesaria la hibridación también forman orbitales\(sp\) híbridos. Los ejemplos incluyen\(\ce{CO_2}\) y\(\ce{C_2H_2}\), que se discutirán con mayor detalle más adelante.
sp² Hibridación
\(\left( \ce{BF_3} \right)\)Se predice que el trifluoruro de boro tiene una geometría plana trigonal por VSEPR. Primero, se promueve un\(2s\) electrón emparejado al\(2p_y\) orbital vacío (véase la figura a continuación).
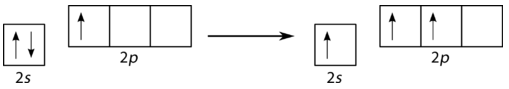
A esto le sigue la hibridación de los tres orbitales ocupados para formar un conjunto de tres\(sp^2\) híbridos, dejando el\(2p_z\) orbital sin hibridar (ver figura a continuación).
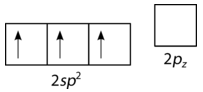
La geometría de los orbitales\(sp^2\) híbridos es plana trigonal, con los lóbulos de los orbitales apuntando hacia las esquinas de un triángulo (ver figura abajo). El ángulo entre dos cualquiera de los lóbulos orbitales híbridos es\(120^\text{o}\). Cada uno puede enlazarse con un\(2p\) orbital desde un átomo de flúor para formar la\(\ce{BF_3}\) molécula plana trigonal.
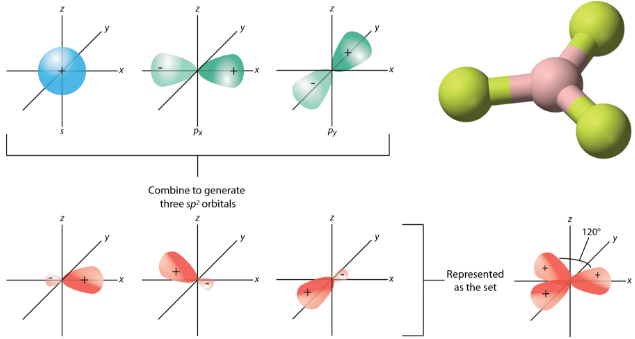
Otras moléculas con geometría de dominio electrónico plano trigonal forman orbitales\(sp^2\) híbridos. \(\left( \ce{O_3} \right)\)El ozono es un ejemplo de una molécula cuya geometría de dominio electrónico es plano trigonal, aunque la presencia de un par solitario en el oxígeno central hace que la geometría molecular se doble. La hibridación del\(\ce{O}\) átomo central del ozono es\(sp^2\).
Resumen
- Los electrones emparejados pueden hibridarse y luego participar en enlaces covalentes.
Revisar
- ¿El átomo de berilio del estado fundamental contiene electrones desapareados?
- ¿Por qué un electrón 2s en Be es promovido a un orbital 2p?
- ¿Cuál es la geometría de los dos orbitales sp?


