9.24: Bonos Sigma y Pi
- Page ID
- 70389
¿Cuántas personas crees que están apretadas en esta calle?
Nuestras mentes pueden manejar dos electrones interactuando entre sí en una esfera espacial. Pero entonces empezamos a poner en dobles enlaces y triples bonos. La forma en que dibujamos estos enlaces en papel sugiere que estamos apretando más electrones en el mismo espacio, y eso no funciona. A los electrones no les gusta ser empujados juntos (sobre todo porque todos tienen cargas negativas que se repelen entre sí). Entonces necesitamos una imagen más compleja que funcione para todos estos electrones.
Bonos Sigma y Pi
El modelo de hibridación ayuda a explicar moléculas con dobles o triples enlaces (ver figura abajo). El eteno\(\left( \ce{C_2H_4} \right)\) contiene un doble enlace covalente entre los dos átomos de carbono y enlaces simples entre los átomos de carbono y los átomos de hidrógeno. Toda la molécula es plana.
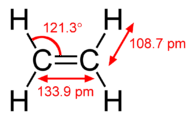
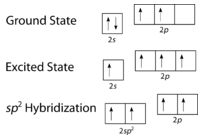
Como puede verse en la siguiente figura, la geometría del dominio electrónico alrededor de cada carbono independientemente es plana trigonal. Esto corresponde a la\(sp^2\) hibridación. Anteriormente, vimos al carbono someterse a\(sp^3\) hibridación en una\(\ce{CH_4}\) molécula, por lo que la promoción electrónica es la misma para el eteno, pero la hibridación ocurre solo entre el\(s\) orbital único y dos de los tres\(p\) orbitales. Esto genera un conjunto de tres\(sp^2\) híbridos, junto con un\(2p_z\) orbital no hibridado. Cada uno contiene un electrón y así es capaz de formar un enlace covalente.
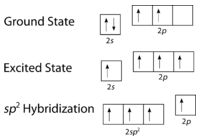
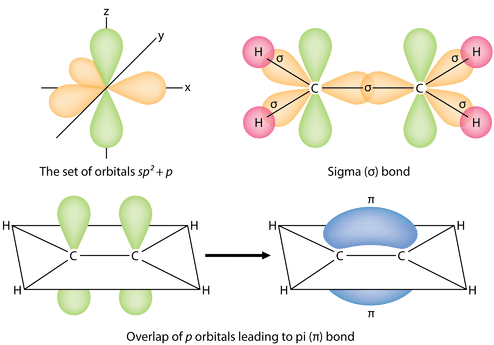
Los tres orbitales\(sp^2\) híbridos se encuentran en un plano, mientras que el\(2p_z\) orbital no hibridado está orientado perpendicular a ese plano. El enlace en\(\ce{C_2H_4}\) se explica de la siguiente manera: uno de los tres\(sp^2\) híbridos forma un enlace al superponerse con el orbital híbrido idéntico en el otro átomo de carbono. Los dos orbitales híbridos restantes forman enlaces al superponerse con el\(1s\) orbital de un átomo de hidrógeno. Finalmente, los\(2p_z\) orbitales de cada átomo de carbono forman otro enlace al superponerse entre sí lateralmente.
Es necesario distinguir entre los dos tipos de enlaces covalentes en una\(\ce{C_2H_4}\) molécula. Un enlace sigma (\(\sigma\)enlace) es un enlace formado por la superposición de orbitales de una manera de extremo a extremo, con la densidad electrónica concentrada entre los núcleos de los átomos de enlace. Un enlace pi (\(\pi\)enlace) es un enlace formado por la superposición de orbitales de manera lado a lado con la densidad de electrones concentrada por encima y por debajo del plano de los núcleos de los átomos de enlace. La siguiente figura muestra los dos tipos de unión en\(\ce{C_2H_4}\). Los orbitales\(sp^2\) híbridos son morados y el\(p_z\) orbital azul. Se forman tres enlaces sigma a partir de cada átomo de carbono para un total de seis enlaces sigma en la molécula. El enlace pi es el “segundo” enlace de los dobles enlaces entre los átomos de carbono, y se muestra como un lóbulo verde alargado que se extiende tanto por encima como por debajo del plano de la molécula. Este plano contiene los seis átomos y todos los enlaces sigma.
En una estructura convencional de electrón-punto de Lewis, se muestra un doble enlace como un doble guión entre los átomos, como en\(\ce{C=C}\). Es importante darse cuenta, sin embargo, de que los dos enlaces son diferentes: uno es un enlace sigma, mientras que el otro es un enlace pi.
El etino\(\left( \ce{C_2H_2} \right)\) es una molécula lineal con un triple enlace entre los dos átomos de carbono (ver figura a continuación). La hibridación es por lo tanto\(sp\).
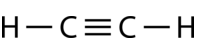
La promoción de un electrón en el átomo de carbono ocurre de la misma manera. Sin embargo, la hibridación ahora involucra solo el\(2s\) orbital y el\(2p_x\) orbital, dejando el\(2p_y\) y los\(2p_z\) orbitales sin hibridar.
Los orbitales\(sp\) híbridos forman un enlace sigma entre sí, así como enlaces sigma a los átomos de hidrógeno. \(p_y\)Tanto los orbitales como los\(p_z\) orbitales de cada átomo de carbono forman enlaces pi entre sí. Al igual que con el eteno, estos solapamientos de lado a lado están por encima y por debajo del plano de la molécula. La orientación de los dos enlaces pi es que son perpendiculares entre sí (ver figura a continuación). Un enlace pi está por encima y por debajo de la línea de la molécula como se muestra, mientras que el otro está delante y detrás de la página.
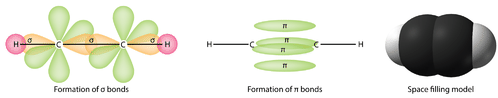
En general, los enlaces simples entre átomos son siempre enlaces sigma. Los dobles enlaces están compuestos por un enlace sigma y un enlace pi. Los enlaces triples están compuestos por un enlace sigma y dos enlaces pi.
Resumen
- Los enlaces sigma se forman entre dos átomos.
- Los enlaces Pi se forman a partir del solapamiento orbital p.
Revisar
- ¿Cuál es la hibridación alrededor de cada carbono en el eteno?
- ¿Cuáles son los dos tipos de bonos en C=C?
- ¿Cuál es la forma de la molécula de eteno?
- ¿Cómo se orientan los enlaces etino pi en relación entre sí?


