13.9: Hervir
- Page ID
- 70433
¿Por qué es más difícil respirar en la cima del Monte Everest que en la parte inferior?
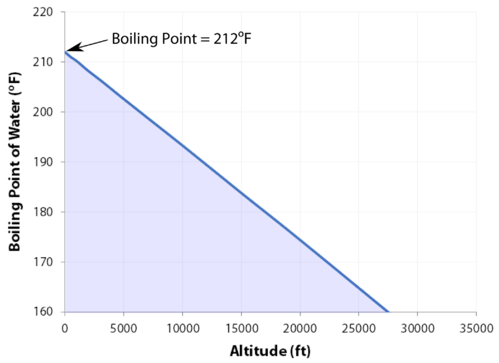
Con 29,029 pies\(\left( 8848 \: \text{m} \right)\), el Monte Everest en la cordillera del Himalaya, en la frontera entre China y Nepal, es el punto más alto de la tierra. Su altitud presenta muchos problemas prácticos a los escaladores. El contenido de oxígeno del aire es mucho menor que al nivel del mar, por lo que es necesario llevar tanques de oxígeno a lo largo (aunque algunos escaladores han alcanzado el pico sin oxígeno). Otro problema es el del agua hirviendo para cocinar alimentos. A pesar de que el agua hierve\(100^\text{o} \text{C}\) a nivel del mar, el punto de ebullición en la cima del Monte Everest es solo de aproximadamente\(70^\text{o} \text{C}\). Esta diferencia hace que sea muy difícil conseguir una taza de té decente (lo que definitivamente frustra a algunos escaladores británicos).
Punto de ebullición
A medida que se calienta un líquido, aumenta la energía cinética promedio de sus partículas. La velocidad de evaporación aumenta a medida que más y más moléculas son capaces de escapar de la superficie del líquido a la fase de vapor. Eventualmente se alcanza un punto cuando las moléculas de todo el líquido tienen suficiente energía cinética para vaporizarse. En este punto, el líquido comienza a hervir. El punto de ebullición es la temperatura a la que la presión de vapor de un líquido es igual a la presión externa. La siguiente figura ilustra la ebullición del líquido.
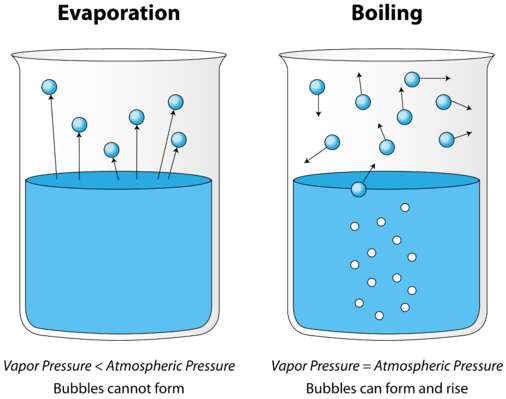
En la imagen de la izquierda, el líquido está por debajo de su punto de ebullición, sin embargo, parte del líquido se evapora. A la derecha, la temperatura se ha incrementado hasta que comienzan a formarse burbujas en el cuerpo del líquido. Cuando la presión de vapor dentro de las burbujas es igual a la presión atmosférica externa, las burbujas se elevan a la superficie del líquido y estallan. La temperatura a la que se produce este proceso es el punto de ebullición del líquido.
El punto de ebullición normal es la temperatura a la que la presión de vapor del líquido es igual a la presión estándar. Debido a que la presión atmosférica puede cambiar según la ubicación, el punto de ebullición de un líquido cambia con la presión externa. El punto de ebullición normal es una constante porque se define en relación con la presión atmosférica estándar de\(760 \: \text{mm} \: \ce{Hg}\) (o\(1 \: \text{atm}\) o\(101.3 \: \text{kPa}\)).
Resumen
- El punto de ebullición es la temperatura a la que la presión de vapor de un líquido es igual a la presión externa.
- A medida que aumenta la altitud, el punto de ebullición disminuye.
Revisar
- ¿Qué sucede cuando se calienta un líquido?
- ¿Cuál es el punto de ebullición?
- ¿Cuál es la presión a la que se determina el punto de ebullición normal?
- ¿El punto de ebullición y el punto de ebullición normal son siempre el mismo valor, a veces el mismo valor, o nunca el mismo valor? Explica tu respuesta.
Explora más
Utilice el siguiente video para responder a las siguientes preguntas:
- El punto de ebullición del agua es de 100°C ¿Cuál es un ejemplo de líquido que hierve a una temperatura superior al punto de ebullición del agua?
- ¿Cuál es un ejemplo de líquido que el punto de ebullición está por debajo de la temperatura ambiente?
- ¿Qué cambio de fase es lo contrario de hervir?


