13.8: Presión de Vapor
- Page ID
- 70444
¿Qué hace que este juguete se mueva?
El pato para beber es un juguete con el que muchos niños (y adultos) disfrutan jugando. Puedes ver al pato bebedor en acción en el siguiente video:
El movimiento del pato ilustra un principio físico llamado presión de vapor. A medida que cambia la presión de vapor, el líquido en el pato se mueve hacia arriba y hacia abajo, haciendo que el pato se mueva.
Presión de Vapor
Cuando un recipiente de líquido parcialmente lleno se sella con un tapón, algunas moléculas de líquido en la superficie se evaporan en la fase de vapor. Sin embargo, las moléculas de vapor no pueden escapar del contenedor. Entonces, después de cierta cantidad de tiempo, el espacio por encima del líquido alcanza un punto en el que no puede contener más moléculas de vapor. Ahora, algunas de las moléculas de vapor se condensan de nuevo en un líquido. El sistema alcanza el punto donde la velocidad de evaporación es igual a la velocidad de condensación (ver figura a continuación). Esto se considera un equilibrio dinámico entre la fase líquida y vapor.
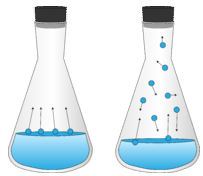
Un equilibrio dinámico se puede ilustrar mediante una ecuación con una flecha doble, lo que significa que la reacción está ocurriendo en ambas direcciones y a la misma velocidad.
\[\ce{H_2O} \left( l \right) \rightleftharpoons \ce{H_2O} \left( g \right)\nonumber \]
La dirección hacia adelante representa el proceso de evaporación, mientras que la dirección inversa representa el proceso de condensación.
Debido a que no pueden escapar del recipiente, las moléculas de vapor por encima de la superficie del líquido ejercen una presión sobre las paredes del recipiente. La presión de vapor es una medida de la presión (fuerza por unidad de área) ejercida por un gas sobre un líquido en un recipiente sellado. La presión de vapor es una propiedad de un líquido basada en la fuerza de sus fuerzas intermoleculares. Un líquido con fuerzas intermoleculares débiles se evapora más fácilmente y tiene una mayor presión de vapor. Un líquido con fuerzas intermoleculares más fuertes no se evapora fácilmente, y por lo tanto tiene una menor presión de vapor. Por ejemplo, el éter dietílico es un líquido no polar con fuerzas de dispersión débiles. Su presión de vapor a\(20^\text{o} \text{C}\) es\(58.96 \: \text{kPa}\). El agua es un líquido polar cuyas moléculas son atraídas entre sí por enlaces de hidrógeno relativamente fuertes. La presión de vapor del agua a\(20^\text{o} \text{C}\) es solo\(2.33 \: \text{kPa}\), mucho menor que la del éter dietílico.
Presión de Vapor y Temperatura
La presión de vapor depende de la temperatura. Cuando el líquido en un recipiente cerrado se calienta, más moléculas escapan de la fase líquida y se evaporan. El mayor número de moléculas de vapor chocan con mayor frecuencia en las paredes del recipiente, lo que resulta en un aumento de la presión. La siguiente tabla muestra la dependencia de la temperatura de la presión de vapor de tres líquidos.
| Tabla\(\PageIndex{1}\): Presión de Vapor (en\(\text{kPa}\) Tres Líquidos a Diferentes Temperaturas | ||||||
|---|---|---|---|---|---|---|
| \ (\ PageIndex {1}\): Presión\(\text{kPa}\) de Vapor (en Tres Líquidos a Diferentes Temperaturas” style="vertical-align:middle; "> | \(0^\text{o} \text{C}\) | \(20^\text{o} \text{C}\) | \(40^\text{o} \text{C}\) | \(60^\text{o} \text{C}\) | \(80^\text{o} \text{C}\) | \(100^\text{o} \text{C}\) |
| \ (\ PageIndex {1}\): Presión\(\text{kPa}\) de Vapor (en Tres Líquidos a Diferentes Temperaturas” style="vertical-align:middle; ">Agua | 0.61 | 2.33 | 7.37 | 19.92 | 47.34 | 101.33 |
| \ (\ PageIndex {1}\): Presión\(\text{kPa}\) de Vapor (en Tres Líquidos a Diferentes Temperaturas” style="vertical-align:middle; ">Etanol | 1.63 | 5.85 | 18.04 | 47.02 | 108.34 | 225.75 |
| \ (\ PageIndex {1}\): Presión\(\text{kPa}\) de Vapor (en Tres Líquidos a Diferentes Temperaturas” style="vertical-align:middle; ">Dietil Ether | 24.70 | 58.96 | 122.80 | 230.65 | 399.11 | 647.87 |
Observe que la dependencia de la temperatura de la presión de vapor no es lineal. De\(0^\text{o} \text{C}\) a\(80^\text{o} \text{C}\), la presión de vapor del agua aumenta en\(46.73 \: \text{kPa}\), mientras que aumenta\(53.99 \: \text{kPa}\) en solo un lapso de veinte grados de\(80^\text{o} \text{C}\) a\(100^\text{o} \text{C}\).
¿Alguna vez intentaste hervir agua en la cima de una montaña? Explora la relación entre altitud, presión de vapor y punto de ebullición en esta simulación:
Resumen
- La presión de vapor es una medida de la presión ejercida por un gas sobre un líquido en un recipiente sellado.
- Fuertes fuerzas intermoleculares producen una menor tasa de evaporación y una menor presión de vapor.
- Las fuerzas intermoleculares débiles producen una mayor tasa de evaporación y una mayor presión de vapor.
- A medida que aumenta la temperatura, la presión de vapor aumenta.
Revisar
- Defina la presión de vapor.
- ¿Cómo afectan las fuerzas intermoleculares a la presión de vapor?
- ¿Cómo afecta la temperatura a la presión de vapor?

