13.15: Clases de Sólidos Cristalinos
- Page ID
- 70452

¿Cuáles son las cosas comunes que conectamos a los cables?
Muchas veces damos por sentado muchas cosas. Simplemente asumimos que obtendremos energía eléctrica cuando conectemos un enchufe a una toma eléctrica. El cable que comprende esa salida es casi siempre de cobre, un material que conduce bien la electricidad. Las propiedades únicas del cobre sólido permiten que los electrones fluyan libremente a través del cable y hacia cualquier dispositivo al que lo conectemos. Entonces podremos disfrutar de la música, la televisión, el trabajo en la computadora, o cualquier otra actividad que queramos emprender.
Clases de Sólidos Cristalinos
Las sustancias cristalinas se pueden describir por los tipos de partículas en ellas, y los tipos de unión química que tienen lugar entre las partículas. Existen cuatro tipos de cristales: (1) iónicos, (2) metálicos, (3) red covalente y (4) moleculares. Las propiedades y ejemplos de cada tipo se describen en la siguiente tabla.
| Tipo de Sólido Cristalino | Ejemplos (fórmulas) | Punto de fusión\(\left( ^\text{o} \text{C} \right)\) | Punto de ebullición normal\(\left( ^\text{o} \text{C} \right)\) |
|---|---|---|---|
| Iónico | \(\ce{NaCl}\) | \ (\ left (^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; ">801 | \ (\ left (^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; ">1413 |
| \(\ce{CaF_2}\) | \ (\ left (^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; ">1418 | \ (\ left (^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; ">1533 | |
| Metálico | \(\ce{Hg}\) | \ (\ left (^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; ">-39 | \ (\ left (^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; ">630 |
| \(\ce{Na}\) | \ (\ left (^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; ">371 | \ (\ left (^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; ">883 | |
| \(\ce{Au}\) | \ (\ left (^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; ">1064 | \ (\ left (^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; ">2856 | |
| \(\ce{W}\) | \ (\ left (^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; ">3410 | \ (\ left (^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; ">5660 | |
| Red Covalente | \(\ce{B}\) | \ (\ left (^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; ">2076 | \ (\ left (^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; ">3927 |
| \(\ce{C}\)(diamante) | \ (\ left (^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; ">3500 | \ (\ left (^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; ">3930 | |
| \(\ce{SiO_2}\) | \ (\ left (^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; ">1600 | \ (\ left (^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; ">2230 | |
| Molecular | \(\ce{H_2}\) | \ (\ left (^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; ">-259 | \ (\ left (^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; ">-253 |
| \(\ce{I_2}\) | \ (\ left (^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; ">114 | \ (\ left (^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; ">184 | |
| \(\ce{NH_3}\) | \ (\ left (^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; ">-78 | \ (\ left (^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; ">-33 | |
| \(\ce{H_2O}\) | \ (\ left (^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; ">0 | \ (\ left (^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; ">100 |
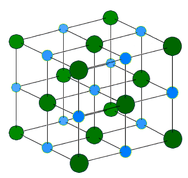
1. Cristales iónicos: La estructura cristalina iónica consiste en alternar cationes cargados positivamente y aniones cargados negativamente (ver figura abajo). Los iones pueden ser monoatómicos o poliatómicos. Generalmente, los cristales iónicos se forman a partir de una combinación de metales del Grupo 1 o 2, y los no metales del Grupo 16 o 17 o iones poliatómicos no metálicos. Los cristales iónicos son duros, quebradizos y tienen altos puntos de fusión. Los compuestos iónicos no conducen la electricidad como sólidos, sino que conducen cuando están fundidos o en solución acuosa.
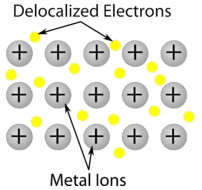
2. Cristal metálico: Los cristales metálicos consisten en cationes metálicos rodeados por un “mar” de electrones de valencia móvil (ver figura abajo). Estos electrones (también denominados electrones deslocalizados) no pertenecen a ningún átomo, sino que son capaces de moverse a través de todo el cristal. Como resultado, los metales son buenos conductores de electricidad. Como se ve en la tabla anterior, los puntos de fusión de los cristales metálicos abarcan un amplio rango.
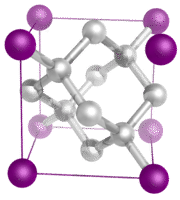
3. Cristales de red covalente: Un cristal de red covalente consiste en átomos en los puntos de la red del cristal, con cada átomo unido covalentemente a sus átomos vecinos más cercanos (ver figura a continuación). La red unida covalentemente es tridimensional y contiene un número muy grande de átomos. Los sólidos de la red incluyen diamante, cuarzo, muchos metaloides y óxidos de metales de transición y metaloides. Los sólidos de la red son duros y quebradizos, con puntos de fusión y ebullición extremadamente altos. Al estar compuestos por átomos en lugar de iones, no conducen electricidad en ningún estado.
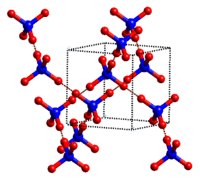
4. Cristales moleculares: Los cristales moleculares suelen consistir en moléculas en los puntos de la red del cristal, mantenidas unidas por fuerzas intermoleculares relativamente débiles (ver figura a continuación). Las fuerzas intermoleculares pueden ser fuerzas de dispersión en el caso de cristales no polares, o fuerzas dipolo-dipolo en el caso de cristales polares. Algunos cristales moleculares, como el hielo, tienen moléculas unidas por enlaces de hidrógeno. Cuando uno de los gases nobles se enfría y solidifica, los puntos de la red son átomos individuales en lugar de moléculas. En todos los casos, las fuerzas intermoleculares que mantienen unidas las partículas son mucho más débiles que los enlaces iónicos o covalentes. Como resultado, los puntos de fusión y ebullición de los cristales moleculares son mucho menores. Al carecer de iones o electrones libres, los cristales moleculares son malos conductores eléctricos.
Resumen
- Los cristales iónicos están compuestos por iones positivos y negativos alternos.
- Los cristales metálicos consisten en cationes metálicos rodeados por un “mar” de electrones de valencia móvil.
- Los cristales covalentes están compuestos por átomos que están unidos covalentemente entre sí.
- Los cristales moleculares se mantienen unidos por fuerzas intermoleculares débiles.
Revisar
- ¿Qué es un cristal iónico?
- ¿Qué tipo de cristal es un diamante?
- ¿Qué fuerzas mantienen unidos los cristales moleculares?
- ¿Qué tipo de cristal es un buen conductor de electricidad?

