13.19: Diagrama general de fases
- Page ID
- 70426
Muchos cohetes utilizan una combinación de queroseno y oxígeno líquido para su combustible. El oxígeno se puede reducir al estado líquido ya sea por enfriamiento o mediante el uso de alta presión. En el caso de un cohete, dado que el oxígeno está en un contenedor esencialmente al aire libre, mantener una temperatura de\(-183^\text{o} \text{C}\) (el punto de ebullición del oxígeno) no es muy práctico. Sin embargo, se puede usar alta presión para forzar el oxígeno al interior de los tanques, haciendo que se licúe para que pueda mezclarse con el queroseno, y proporcionar un potente encendido para mover el cohete.
Diagramas de Fase
La relación entre los estados sólido, líquido y vapor (gas) de una sustancia se puede mostrar en función de la temperatura y la presión en un solo diagrama. Un diagrama de fases es un gráfico que muestra las condiciones de temperatura y presión bajo las cuales existe una sustancia en las fases sólida, líquida y gaseosa. Examine el diagrama general de fases que se muestra en la siguiente figura. En cada una de las tres regiones coloreadas del diagrama, la sustancia se encuentra en un solo estado (o fase). Las líneas oscuras que actúan como límite entre esas regiones representan las condiciones bajo las cuales las dos fases están en equilibrio.
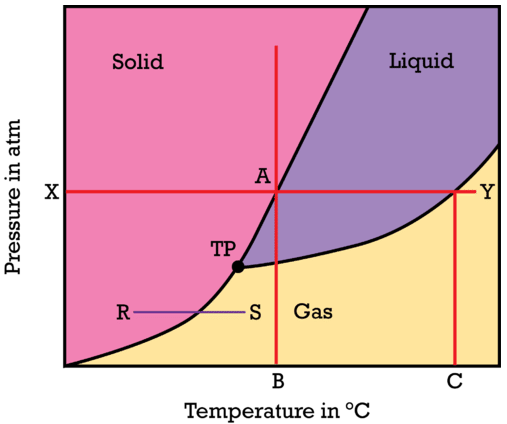
Encuentre el\(X\) sobre el eje de presión y presuma que el valor de\(X\) es presión estándar de\(1 \: \text{atm}\). A medida que uno se mueve de izquierda a derecha a través de la línea roja, la temperatura de la sustancia sólida se incrementa mientras la presión permanece constante. Cuando\(A\) se alcanza el punto, la sustancia se funde y la temperatura\(B\) en el eje horizontal representa el punto de fusión normal de la sustancia. Avanzando hacia la derecha, la sustancia hierve en un punto\(Y\) y así el punto\(C\) en el eje horizontal representa el punto de ebullición normal de la sustancia. A medida que la temperatura aumenta a una presión constante, la sustancia cambia de sólida a líquida a gaseosa.
Comienza justo por encima del punto\(B\) en el eje de temperatura y sigue la línea roja verticalmente. A muy baja presión, las partículas de la sustancia están muy separadas entre sí y la sustancia se encuentra en estado gaseoso. A medida que aumenta la presión, las partículas de la sustancia son forzadas cada vez más juntas. Finalmente, las partículas son empujadas tan juntas que las fuerzas atractivas hacen que la sustancia se condense en estado líquido. El aumento continuo de la presión sobre el líquido eventualmente hará que la sustancia se solidifique. Para la mayoría de las sustancias, el estado sólido es más denso que el estado líquido y por lo tanto, poner un líquido bajo gran presión hará que se convierta en sólido. El segmento de línea\(R\) -\(S\) representa el proceso de sublimación, donde la sustancia cambia directamente de un sólido a un gas. A una presión suficientemente baja, la fase líquida no existe. El punto etiquetado\(TP\) se llama el punto triple. El punto triple es la única condición de temperatura y presión donde los estados sólido, líquido y vapor de una sustancia pueden coexistir en equilibrio.
Resumen
- Un diagrama de fases grafica las condiciones de temperatura y presión bajo las cuales existe una sustancia en los estados sólido, líquido y gas.
- El punto triple es la única condición de temperatura y presión donde los estados sólido, líquido y vapor de una sustancia pueden coexistir en equilibrio.

