13.18: Curvas de Calefacción y Refrigeración
- Page ID
- 70442
Durante la vida de Mark Twain (nombre real: Samuel Langhorne Clemens, 1835-1910), el barco de vapor era un importante medio de transporte en los ríos y lagos de Estados Unidos. El propio Twain fue piloto de barco de vapor en el río Mississippi por un período de tiempo, y tomó su seudónimo de la medición de la profundidad del agua (doce pies, que era una profundidad segura para las embarcaciones). Los barcos obtuvieron su poder de vapor, agua líquida convertida en gas a altas temperaturas. El vapor empujaría los pistones del motor, haciendo que las ruedas de paletas giren e impulsen la embarcación.
Curvas de Calefacción
Imagina que tienes un bloque de hielo que está a una temperatura de\(-30^\text{o} \text{C}\), muy por debajo de su punto de fusión. El hielo se encuentra en un recipiente cerrado. A medida que el calor se agrega constantemente al bloque de hielo, las moléculas de agua comenzarán a vibrar cada vez más rápido a medida que absorben la energía cinética. Eventualmente, cuando el hielo se haya calentado\(0^\text{o} \text{C}\), la energía agregada comenzará a romper el enlace de hidrógeno que mantiene las moléculas de agua en su lugar cuando está en forma sólida. A medida que el hielo se derrite, su temperatura no sube. Toda la energía que se está poniendo en el hielo entra en el proceso de fusión y no en ningún aumento de temperatura. Durante el proceso de fusión, los dos estados, sólido y líquido, están en equilibrio entre sí. Si el sistema estuviera aislado en ese punto y no se permitiera que entrara o saliera energía, la mezcla de hielo-agua en\(0^\text{o} \text{C}\) quedaría. La temperatura siempre es constante durante un cambio de estado.
El calentamiento continuo del agua después de que el hielo se haya derretido completamente aumentará ahora la energía cinética de las moléculas líquidas y la temperatura aumentará. Suponiendo que la presión atmosférica es estándar, la temperatura aumentará de manera constante hasta que alcance\(100^\text{o} \text{C}\). En este punto, la energía añadida del calor provocará que el líquido comience a vaporizarse. Al igual que con el cambio de estado anterior, la temperatura permanecerá en\(100^\text{o} \text{C}\) mientras las moléculas de agua van del estado líquido al gas o vapor. Una vez que todo el líquido se haya evaporado por completo, el calentamiento continuo del vapor (ya que el recipiente está cerrado) aumentará su temperatura por encima\(100^\text{o} \text{C}\).
El experimento descrito anteriormente se puede resumir en una gráfica llamada curva de calentamiento (figura a continuación).
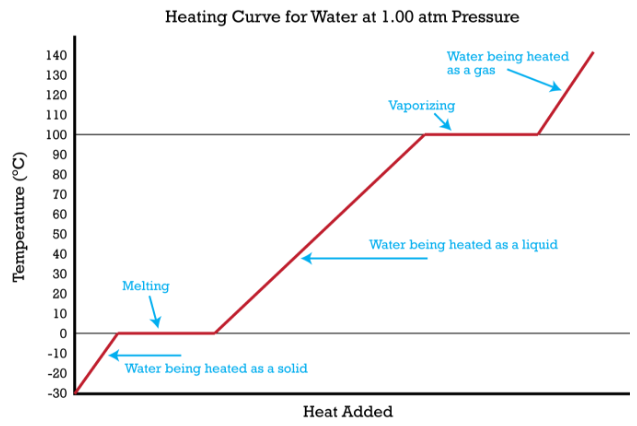
El cambio de comportamiento de estado de todas las sustancias se puede representar con una curva de calentamiento de este tipo. Los puntos de fusión y ebullición de la sustancia pueden ser determinados por las líneas horizontales o mesetas en la curva. Otras sustancias tienen puntos de fusión y ebullición que son diferentes a los del agua. Una excepción a esta curva de calentamiento del plano es para una sustancia como el dióxido de carbono, que sublima en lugar de fundirse a presión estándar. La curva de calentamiento para el dióxido de carbono tendría sólo una meseta, a la temperatura de sublimación de\(\ce{CO_2}\).
Todo el experimento podría ejecutarse a la inversa. El vapor de arriba\(100^\text{o} \text{C}\) podría enfriarse de manera constante hasta\(100^\text{o} \text{C}\), momento en el que se condensaría en agua líquida. El agua podría entonces enfriarse hasta\(0^\text{o} \text{C}\), momento en el cual el enfriamiento continuo congelaría el agua a hielo. El hielo podría entonces enfriarse hasta un punto por debajo\(0^\text{o} \text{C}\). Esto podría ser diagramado en una curva de enfriamiento que sería la inversa de la curva de calentamiento.
Resumen de cambios estatales
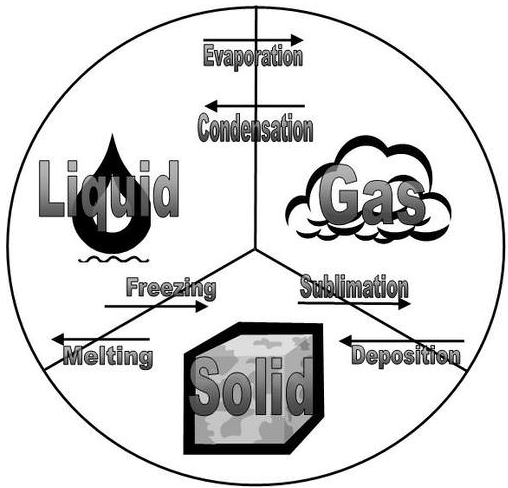
Todos los cambios de estado que ocurren entre sólido, líquido y gas se resumen en el diagrama de la siguiente figura. La congelación es lo opuesto a la fusión, y ambos representan el equilibrio entre los estados sólido y líquido. La evaporación ocurre cuando un líquido se convierte en un gas. La condensación es lo opuesto a la vaporización, y ambas representan el equilibrio entre los estados líquido y gaseoso. La deposición es lo opuesto a la sublimación, y ambas representan el equilibrio entre los estados sólido y gaseoso.
Resumen
- Se puede producir un cambio de estado poniendo calor en un sistema o retirándolo del sistema.
- La temperatura de un sistema no cambiará mientras la sustancia esté experimentando un cambio de sólido a líquido a gas, así como a la inversa.
- La congelación es lo opuesto al derretimiento.
- La evaporación ocurre cuando un líquido se convierte en un gas.
- La condensación es lo opuesto a la vaporización.
- La deposición es lo opuesto a la sublimación.

