14.2: Factores que afectan la presión del gas
- Page ID
- 71125
La presión del aire en una básquetbol tiene que ser ajustada para que la pelota rebote a la altura correcta. Antes de un partido, los oficiales revisan el balón dejándolo caer desde la altura de los hombros y viendo hasta qué punto atrás rebota. ¿Qué haría un funcionario si el balón no rebotara lo suficientemente alto, o si rebotara demasiado alto?
La presión dentro de un contenedor depende de la cantidad de gas dentro del contenedor. Si un basquetbol no rebota lo suficientemente alto, un funcionario podría remediar la situación usando una bomba de mano y agregando más aire a la pelota. Por el contrario, si rebota demasiado alto, el funcionario podría dejar salir algo de aire de la pelota.
Factores que afectan la presión del gas
Recordemos de la teoría cinético-molecular que las partículas de gas se mueven aleatoriamente y en líneas rectas hasta que chocan elásticamente con otras partículas de gas, o con una de las paredes del contenedor. Son estas colisiones con las paredes del contenedor las que definen la presión del gas. Se utilizan cuatro variables para describir la condición de un gas: presión\(\left( P \right)\)\(\left( V \right)\), volumen\(\left( T \right)\), temperatura y la cantidad del gas medida por el número de moles (\ izquierda (n\ derecha)\). Examinaremos por separado cómo el volumen, la temperatura y la cantidad de gas afectan cada uno a la presión de una muestra de gas encerrada.
Cantidad de Gas
La siguiente figura muestra lo que sucede cuando se agrega aire a un contenedor rígido. Un contenedor rígido es aquel que es incapaz de expandirse o contraerse. Un bote de acero es un ejemplo de un contenedor rígido.
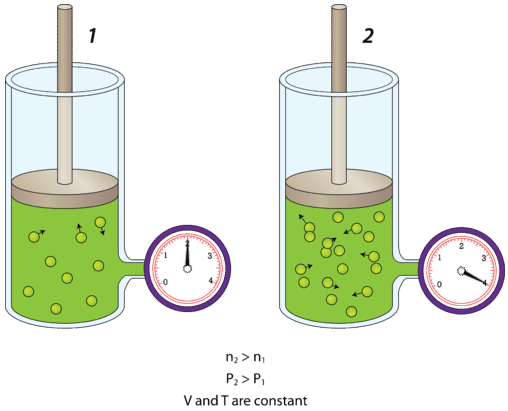
El bote de la izquierda contiene un gas a cierta presión. La bomba de aire conectada se utiliza entonces para duplicar la cantidad de gas en el bote. Dado que el bote no puede expandirse, el mayor número de moléculas de aire golpeará las paredes internas del bote dos veces más frecuentemente que antes. El resultado es que la presión dentro del bote se duplica. Como se podría imaginar, si se agrega cada vez más aire continuamente a un contenedor rígido, eventualmente puede estallar. Reducir el número de moléculas en un recipiente rígido tiene el efecto contrario, y la presión disminuye.
Volumen
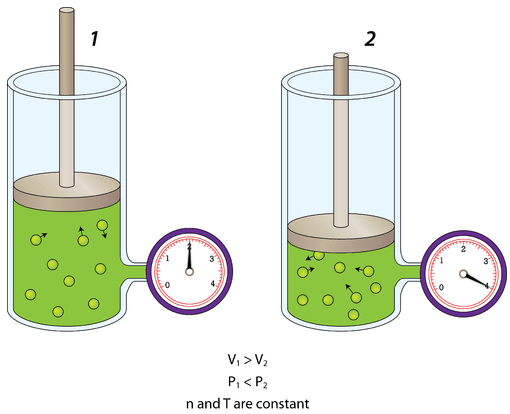
La presión también se ve afectada por el volumen del contenedor. Si se disminuye el volumen de un contenedor, las moléculas de gas tienen menos espacio en el que moverse. En consecuencia, golpearán con mayor frecuencia las paredes del contenedor, y la presión aumenta.
La siguiente figura muestra un cilindro de gas cuyo volumen es controlado por un pistón ajustable. A la izquierda, el pistón se saca mayormente y el manómetro lee cierta presión. A la derecha, el pistón ha sido empujado para que el volumen de la porción cerrada del contenedor donde se ubica el gas se haya cortado por la mitad. La presión del gas se duplica. Aumentar el volumen del contenedor tendría el efecto contrario, y la presión del gas disminuiría.
Temperatura
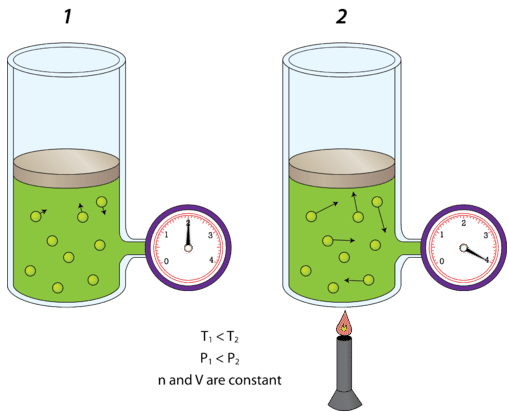
Sería muy desaconsejable colocar una lata de sopa sobre una fogata sin ventilar la lata. A medida que la lata se calienta, puede explotar. La teoría cinético-molecular explica por qué. Al aire dentro de la lata rígida de sopa se le da más energía cinética por el calor que viene de la fogata. La energía cinética hace que las moléculas de aire se muevan más rápido; impactan las paredes del contenedor con mayor frecuencia y con más fuerza. El aumento de presión en el interior puede eventualmente superar la fuerza de la lata y explotará. Un factor adicional es que la sopa puede comenzar a hervir, lo que luego auxiliará aún más gas y más presión al interior de la lata.
En la siguiente figura se muestra un cilindro de gas (izquierda) que se encuentra a temperatura ambiente\(\left( 300 \: \text{K} \right)\). A la derecha, el cilindro se ha calentado hasta que la temperatura Kelvin se ha duplicado a\(600 \: \text{K}\). La energía cinética de las moléculas de gas aumenta, por lo que las colisiones con las paredes del contenedor son ahora más contundentes que antes. En consecuencia, la presión del gas se duplica. Disminuir la temperatura tendría el efecto contrario, y la presión de un gas encerrado disminuiría.
Resumen
- Un incremento en el número de moléculas de gas, mientras que el volumen del contenedor se mantiene constante, aumenta la presión.
- Una disminución en el volumen del contenedor aumenta la presión del gas.
- Un aumento en la temperatura de un gas en un contenedor rígido aumenta la presión.

