14.3: Ley de Boyle
- Page ID
- 71081
Cada día se lanzan cientos de globos meteorológicos. Hecho de una goma sintética y portando una caja de instrumentos, cada globo lleno de helio se eleva hacia el cielo. A medida que un globo gana altitud, la presión atmosférica disminuye y el globo se expande. En algún momento el globo estalla debido a la expansión; los instrumentos caen (ayudados por un paracaídas) para ser recuperados y estudiados para obtener información sobre el clima.
Ley de Boyle
Robert Boyle (1627-1691), un químico inglés, es ampliamente considerado como uno de los fundadores de la ciencia experimental moderna de la química. Descubrió que duplicar la presión de una muestra de gas encerrada, manteniendo constante su temperatura, provocó que el volumen del gas se redujera a la mitad. La ley de Boyle establece que el volumen de una determinada masa de gas varía inversamente con la presión cuando la temperatura se mantiene constante. De esta manera se describe una relación inversa. A medida que una variable aumenta de valor, la otra variable disminuye.
Físicamente, ¿qué está pasando? Las moléculas de gas se mueven y están a cierta distancia unas de otras. Un aumento en la presión empuja a las moléculas más juntas, reduciendo el volumen. Si disminuye la presión, los gases son libres de moverse en un volumen mayor.

Matemáticamente, la ley de Boyle se puede expresar por la ecuación:
\[P \times V = k\nonumber \]
El\(k\) es una constante para una muestra dada de gas y depende únicamente de la masa del gas y de la temperatura. La siguiente tabla muestra los datos de presión y volumen para una cantidad establecida de gas a temperatura constante. La tercera columna representa el valor de la constante\(\left( k \right)\) para estos datos y siempre es igual a la presión multiplicada por el volumen. A medida que una de las variables cambia, la otra cambia de tal manera que el producto de\(P \times V\) siempre permanece igual. En este caso particular, esa constante lo es\(500 \: \text{atm} \cdot \text{mL}\).
| Presión\(\left( \text{atm} \right)\) | Volumen\(\left( \text{mL} \right)\) | \(P \times V = k\)\(\left( \text{atm} \cdot \text{mL} \right)\) |
|---|---|---|
| \ (\ left (\ text {atm}\ right)\)” style="vertical-align:middle; text-align:center; ">0.5 | \ (\ left (\ text {mL}\ right)\)” style="vertical-align:middle; text-align:center; ">1000 | \ (P\ veces V = k\)\(\left( \text{atm} \cdot \text{mL} \right)\) "style="vertical-align:middle; text-align:center;" >500 |
| \ (\ left (\ text {atm}\ right)\)” style="vertical-align:middle; text-align:center; ">0.625 | \ (\ left (\ text {mL}\ right)\)” style="vertical-align:middle; text-align:center; ">800 | \ (P\ veces V = k\)\(\left( \text{atm} \cdot \text{mL} \right)\) "style="vertical-align:middle; text-align:center;" >500 |
| \ (\ left (\ text {atm}\ right)\)” style="vertical-align:middle; text-align:center; ">1.0 | \ (\ left (\ text {mL}\ right)\)” style="vertical-align:middle; text-align:center; ">500 | \ (P\ veces V = k\)\(\left( \text{atm} \cdot \text{mL} \right)\) "style="vertical-align:middle; text-align:center;" >500 |
| \ (\ left (\ text {atm}\ right)\)” style="vertical-align:middle; text-align:center; ">2.0 | \ (\ left (\ text {mL}\ right)\)” style="vertical-align:middle; text-align:center; ">250 | \ (P\ veces V = k\)\(\left( \text{atm} \cdot \text{mL} \right)\) "style="vertical-align:middle; text-align:center;" >500 |
| \ (\ left (\ text {atm}\ right)\)” style="vertical-align:middle; text-align:center; ">5.0 | \ (\ left (\ text {mL}\ right)\)” style="vertical-align:middle; text-align:center; ">100 | \ (P\ veces V = k\)\(\left( \text{atm} \cdot \text{mL} \right)\) "style="vertical-align:middle; text-align:center;" >500 |
| \ (\ left (\ text {atm}\ right)\)” style="vertical-align:middle; text-align:center; ">8.0 | \ (\ left (\ text {mL}\ right)\)” style="vertical-align:middle; text-align:center; ">62.5 | \ (P\ veces V = k\)\(\left( \text{atm} \cdot \text{mL} \right)\) "style="vertical-align:middle; text-align:center;" >500 |
| \ (\ left (\ text {atm}\ right)\)” style="vertical-align:middle; text-align:center; ">10.0 | \ (\ left (\ text {mL}\ right)\)” style="vertical-align:middle; text-align:center; ">50 | \ (P\ veces V = k\)\(\left( \text{atm} \cdot \text{mL} \right)\) "style="vertical-align:middle; text-align:center;" >500 |
Un gráfico de los datos de la tabla ilustra adicionalmente la naturaleza de relación inversa de la Ley de Boyle (véase la figura a continuación). El volumen se traza en el\(x\) eje -eje, con la presión correspondiente en el\(y\) eje -eje.
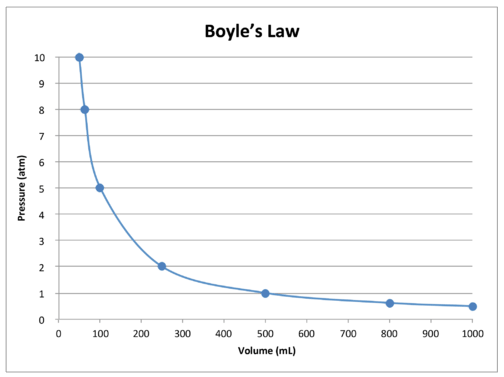
La Ley de Boyle se puede utilizar para comparar las condiciones cambiantes de un gas. Utilizamos\(P_1\) y\(V_1\) para representar la presión inicial y el volumen inicial de un gas. Después de que se haya realizado un cambio,\(P_2\) y\(V_2\) representan la presión final y el volumen. La relación matemática de la Ley de Boyle se convierte en:
\[P_1 \times V_1 = P_2 \times V_2\nonumber \]
Esta ecuación se puede utilizar para calcular cualquiera de las cuatro cantidades si se conocen las otras tres.
Ejemplo\(\PageIndex{1}\)
Una muestra de gas oxígeno tiene un volumen de\(425 \: \text{mL}\) cuando la presión es igual a\(387 \: \text{kPa}\). Se permite que el gas se expanda en un\(1.75 \: \text{L}\) contenedor. Calcular la nueva presión del gas.
Solución
Paso 1: Enumere las cantidades conocidas y planifique el problema.
Conocido
- \(P_1 = 387 \: \text{kPa}\)
- \(V_1 = 425 \: \text{mL}\)
- \(V_2 = 1.75 \: \text{L} = 1750 \: \text{mL}\)
Desconocido
Usa la Ley de Boyle para resolver por la presión desconocida\(\left( P_2 \right)\). Es importante que los dos volúmenes (\(V_1\)y\(V_2\)) se expresen en las mismas unidades, así se\(V_2\) ha convertido a\(\text{mL}\).
Paso 2: Resolver.
En primer lugar, reorganizar la ecuación algebraicamente para resolver para\(P_2\).
\[P_2 = \frac{P_1 \times V_1}{V_2}\nonumber \]
Ahora sustituya las cantidades conocidas en la ecuación y resuelva.
\[P_2 = \frac{387 \: \text{kPa} \times 425 \: \text{mL}}{1750 \: \text{mL}} = 94.0 \: \text{kPa}\nonumber \]
Paso 3: Piensa en tu resultado.
El volumen ha aumentado ligeramente por encima de 4 veces su valor original y por lo tanto la presión disminuye en aproximadamente una cuarta parte. La presión está adentro\(\text{kPa}\) y el valor tiene tres cifras significativas. Tenga en cuenta que cualquier unidad de presión o volumen se puede usar siempre que sean consistentes a lo largo del problema.

