17.3: Procesos exotérmicos y endotérmicos
- Page ID
- 70464
Una fogata es un ejemplo de termoquímica básica. La reacción se inicia mediante la aplicación de calor de un fósforo. Continúa la reacción convirtiendo la madera en dióxido de carbono y agua (entre otras cosas), liberando energía térmica en el proceso. Esta energía térmica se puede usar para cocinar alimentos, asar malvaviscos o simplemente para mantener el calor cuando hace frío afuera.
Procesos exotérmicos y endotérmicos
Cuando ocurren cambios físicos o químicos, generalmente van acompañados de una transferencia de energía. La ley de conservación de la energía establece que en ningún proceso físico o químico, la energía no se crea ni se destruye. En otras palabras, se conserva toda la energía en el universo. Para comprender mejor los cambios energéticos que ocurren durante una reacción, necesitamos definir dos partes del universo: el sistema y el entorno. El sistema es la porción específica de la materia en un espacio dado que se está estudiando durante un experimento o una observación. El entorno es todo en el universo que no forma parte del sistema. En términos prácticos para un químico de laboratorio, el sistema son los químicos particulares que se están reaccionando, mientras que el entorno es la proximidad inmediata dentro de la habitación. Durante la mayoría de los procesos, la energía se intercambia entre el sistema y el entorno. Si el sistema pierde cierta cantidad de energía, esa misma cantidad de energía es ganada por el entorno. Si el sistema gana cierta cantidad de energía, esa energía es suministrada por el entorno.
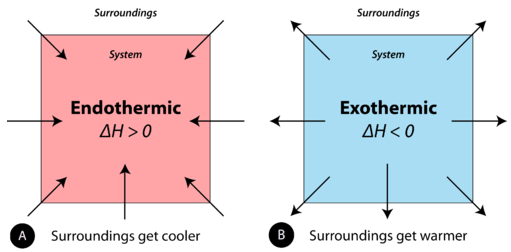
Una reacción química o cambio físico es endotérmica si el sistema absorbe el calor del entorno. En el curso de un proceso endotérmico, el sistema gana calor del entorno, y así la temperatura del entorno disminuye. La cantidad de calor para un proceso está representada por la letra\(q\). El signo de\(q\) para un proceso endotérmico es positivo porque el sistema está ganando calor. Una reacción química o cambio físico es exotérmico si el sistema libera calor al entorno. Debido a que los alrededores están ganando calor del sistema, la temperatura de los alrededores aumenta. El signo de\(q\) para un proceso exotérmico es negativo porque el sistema está perdiendo calor.
Unidades de Calor
El flujo de calor se mide en una de dos unidades comunes: la caloría y la joule. El joule\(\left( \text{J} \right)\) es la unidad de energía SI. La caloría es familiar porque se usa comúnmente cuando se refiere a la cantidad de energía contenida dentro de los alimentos. Una caloría\(\left( \text{cal} \right)\) es la cantidad de calor requerida para elevar la temperatura de 1 gramo de agua por\(1^\text{o} \text{C}\). Por ejemplo, elevar la temperatura\(100 \: \text{g}\) del agua de\(20^\text{o} \text{C}\) a\(22^\text{o} \text{C}\) requeriría\(100 \times 2 = 200 \: \text{cal}\).
Las calorías contenidas dentro de los alimentos son en realidad kilocalorías\(\left( \text{kcal} \right)\). Es decir, si un cierto refrigerio contiene 85 calorías de los alimentos, en realidad contiene\(85 \: \text{kcal}\) o\(85,000 \: \text{cal}\). Para hacer la distinción, la caloría dietética se escribe con una C. mayúscula.
\[1 \: \text{kilocalorie} = 1 \: \text{Calorie} = 1000 \: \text{calories}\nonumber \]
Decir que la merienda “contiene” 85 Calorías significa que\(85 \: \text{kcal}\) de energía se liberan cuando esa merienda es procesada por el cuerpo humano.
Los cambios de calor en las reacciones químicas se miden típicamente en julios en lugar de calorías. A continuación se muestra la conversión entre un joule y una caloría.
\[1 \: \text{J} = 0.2390 \: \text{cal or} \: 1 \: \text{cal} = 4.184 \: \text{J}\nonumber \]
Podemos calcular la cantidad de calor liberado en kilojulios cuando se digiere una hamburguesa de 400 calorías:
\[400. \: \text{Cal} = 400. \: \text{kcal} \times \frac{4.184 \: \text{kJ}}{1 \: \text{kcal}} = 1.67 \times 10^3 \: \text{kJ}\nonumber \]
Resumen
- La ley de conservación de la energía establece que en ningún proceso físico o químico, la energía no se crea ni se destruye.
- Una porción específica de la materia en un espacio dado que se está estudiando durante un experimento o una observación es el sistema.
- El entorno es todo en el universo que no forma parte del sistema.
- Una reacción química o cambio físico es endotérmica si el sistema absorbe el calor del entorno.
- Una reacción o cambio es exotérmico si el sistema libera calor al entorno.

