17.10: Calores de Fusión y Solidificación
- Page ID
- 70457
Supongamos que estás sosteniendo un cubito de hielo en la mano. Se siente frío porque la energía térmica sale de tu mano y entra en el cubito de hielo. ¿Qué pasa con el cubito de hielo? Se derrite. Sin embargo, la temperatura durante un cambio de fase permanece constante. Por lo que el calor que se está perdiendo por tu mano no eleva la temperatura del hielo por encima de su temperatura de fusión de\(0^\text{o} \text{C}\). Más bien, todo el calor entra en el cambio de estado. La energía se absorbe durante el proceso de convertir el hielo en agua. El agua que se produce también permanece\(0^\text{o} \text{C}\) hasta que todo el hielo se derrita.
Calores de Fusión y Solidificación
Todos los sólidos absorben el calor a medida que se funden para convertirse en líquidos. La ganancia de calor en este proceso endotérmico va a cambiar el estado, en lugar de cambiar la temperatura. El calor molar de fusión\(\left( \Delta H_\text{fus} \right)\) de una sustancia es el calor absorbido por un mol de esa sustancia a medida que se convierte de un sólido a un líquido. Dado que la fusión de cualquier sustancia absorbe calor, se deduce que la congelación de cualquier sustancia libera calor. El calor molar de solidificación\(\left( \Delta H_\text{solid} \right)\) de una sustancia es el calor liberado por un mol de esa sustancia a medida que se convierte de un líquido a un sólido. Dado que la fusión y solidificación de una sustancia dada son los procesos exactamente opuestos, el valor numérico del calor molar de fusión es el mismo que el valor numérico del calor molar de solidificación, pero de signo opuesto. En otras palabras,\(\Delta H_\text{fus} = - \Delta H_\text{solid}\). La siguiente figura muestra todos los posibles cambios de estado junto con la dirección del flujo de calor durante cada proceso.
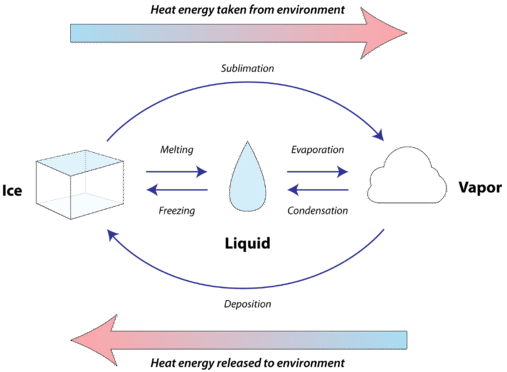
Cada sustancia tiene un valor único por su calor molar de fusión, dependiendo de la cantidad de energía requerida para interrumpir las fuerzas intermoleculares presentes en el sólido. Cuando\(1 \: \text{mol}\) de hielo en\(0^\text{o} \text{C}\) se convierte en\(1 \: \text{mol}\) de agua líquida en\(0^\text{o} \text{C}\),\(6.01 \: \text{kJ}\) de calor son absorbidos de los alrededores. Cuando\(1 \: \text{mol}\) de agua en\(0^\text{o} \text{C}\) se congela a hielo en\(0^\text{o} \text{C}\),\(6.01 \: \text{kJ}\) de calor se libera en los alrededores.
\[\begin{array}{ll} \ce{H_2O} \left( s \right) \rightarrow \ce{H_2O} \left( l \right) & \Delta H_\text{fus} = 6.01 \: \text{kJ/mol} \\ \ce{H_2O} \left( l \right) \rightarrow \ce{H_2O} \left( s \right) & \Delta H_\text{solid} = -6.01 \: \text{kJ/mol} \end{array}\nonumber \]
Los calores molares de fusión y solidificación de una sustancia determinada pueden utilizarse para calcular el calor absorbido o liberado cuando se funden o congelan diversas cantidades.
Ejemplo\(\PageIndex{1}\)
Calcular el calor absorbido cuando\(31.6 \: \text{g}\) el hielo\(0^\text{o} \text{C}\) está completamente derretido.
Solución
Paso 1: Enumere las cantidades conocidas y planifique el problema.
Conocido
- \(= 31.6 \: \text{g}\)Hielo masivo
- Masa molar\(\ce{H_2O} = 18.02 \: \text{g/mol}\)
- Calor molar de fusión\(= 6.01 \: \text{kJ/mol}\)
Desconocido
La masa de hielo se convierte primero en moles. Esto se multiplica entonces por el factor de conversión de con el\(\left( \frac{6.01 \: \text{kJ}}{1 \: \text{mol}} \right)\) fin de encontrar el\(\text{kJ}\) de calor absorbido.
Paso 2: Resolver.
\[31.6 \: \text{g ice} \times \frac{1 \: \text{mol ice}}{18.02 \: \text{g ice}} \times \frac{6.01 \: \text{kJ}}{1 \: \text{mol ice}} = 10.5 \: \text{kJ}\nonumber \]
Paso 3: Piensa en tu resultado.
La cantidad dada es un poco menos de 2 moles de hielo, y así solo menos\(12 \: \text{kJ}\) del calor es absorbido por el proceso de fusión.
Resumen
- El calor molar de fusión\(\left( \Delta H_\text{fus} \right)\) de una sustancia es el calor absorbido por un mol de esa sustancia a medida que se convierte de un sólido a un líquido.
- El calor molar de solidificación\(\left( \Delta H_\text{solid} \right)\) de una sustancia es el calor liberado por un mol de esa sustancia a medida que se convierte de un líquido a un sólido.
- Se describen los cálculos de los cambios de calor durante la fusión y solidificación.

