17.12: Problemas de varios pasos con cambios de estado
- Page ID
- 70500
Si tienes un cubito de hielo, ¿qué proceso tomará más energía, el derretimiento de ese cubito de hielo o la conversión del agua en vapor? La respuesta corta es que se necesita más energía para convertir el agua en vapor. La respuesta larga es realmente una serie de preguntas: ¿Cómo se llega de un punto a otro? ¿Cuál es la temperatura del hielo? ¿Cuál es la masa de ese cubito de hielo? Se trata de un largo proceso para llevar el material desde el punto inicial hasta el punto final.
Problemas de varios pasos con cambios de estado
Las curvas de calentamiento muestran los cambios de fase que sufre una sustancia a medida que el calor se absorbe continuamente.
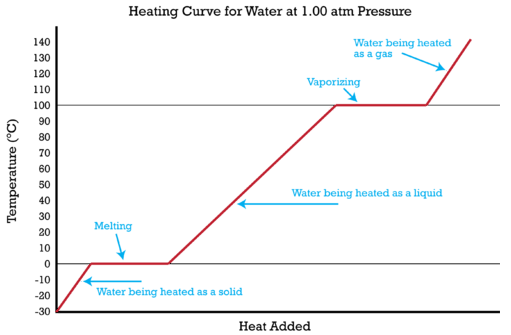
El calor específico de una sustancia nos permite calcular el calor absorbido o liberado a medida que cambia la temperatura de la sustancia. Es posible combinar ese tipo de problema con un cambio de estado para resolver un problema que involucra múltiples pasos. La figura anterior muestra hielo al\(-30^\text{o} \text{C}\) ser convertido en un proceso de cinco etapas en agua gaseosa (vapor) en\(140^\text{o} \text{C}\). Ahora es posible calcular el calor absorbido durante todo ese proceso. El proceso y los cálculos requeridos se resumen a continuación.
1. El hielo se calienta de\(-30^\text{o} \text{C}\) a\(0^\text{o} \text{C}\). El calor absorbido se calcula utilizando el calor específico del hielo y la ecuación\(\Delta H = c_p \times m \times \Delta T\).
2. El hielo se derrite en\(0^\text{o} \text{C}\). El calor absorbido se calcula multiplicando los moles de hielo por el calor molar de fusión.
3. El agua en\(0^\text{o} \text{C}\) se calienta a\(100^\text{o} \text{C}\). El calor absorbido se calcula utilizando el calor específico del agua y la ecuación\(\Delta H = c_p \times m \times \Delta T\).
4. El agua se vaporiza a vapor a\(100^\text{o} \text{C}\). El calor absorbido se calcula multiplicando los moles de agua por el calor molar de vaporización.
5. El vapor se calienta de\(100^\text{o} \text{C}\) a\(140^\text{o} \text{C}\). El calor absorbido se calcula utilizando el calor específico del vapor y la ecuación\(\Delta H = c_p \times m \times \Delta T\).
Ejemplo\(\PageIndex{1}\)
Calcular la cantidad total de calor absorbido (in\(\text{kJ}\)) cuando\(2.00 \: \text{mol}\) de hielo at\(-30^\text{o} \text{C}\) se convierte en vapor a\(140.0^\text{o} \text{C}\). Los calores específicos requeridos se pueden encontrar en la tabla en “Capacidad de Calor y Calor Específico”.
Solución
Paso 1: Enumere las cantidades conocidas y planifique el problema.
Conocido
- \(2.00 \: \text{mol}\)hielo\(= 36.04 \: \text{g}\) hielo
- \(c_p\)(hielo)\(= 2.06 \: \text{J/g}^\text{o} \text{C}\)
- \(c_p\)(agua)\(= 4.18 \: \text{J/g}^\text{o} \text{C}\)
- \(c_p\)(vapor)\(= 1.87 \: \text{J/g}^\text{o} \text{C}\)
- \(\Delta H_\text{fus} = 6.01 \: \text{kJ/mol}\)
- \(\Delta H_\text{vap} = 40.7 \: \text{kJ/mol}\)
Desconocido
Siga los pasos descritos anteriormente. Tenga en cuenta que la masa del agua es necesaria para los cálculos que involucran el calor específico, mientras que los moles de agua son necesarios para los cálculos que implican cambios de estado. Todas las cantidades de calor deben estar en kilojulios para que se puedan sumar para obtener un total para el proceso de cinco pasos.
Paso 2: Resolver.
- \[\Delta H_1 = 2.06 \: \text{J/g}^\text{o} \text{C} \times 36.04 \: \text{g} \times 30^\text{o} \text{C} \times \frac{1 \: \text{kJ}}{1000 \: \text{J}} = 2.23 \: \text{kJ}\nonumber \]
- \[\Delta H_2 = 2.00 \: \text{mol} \times \frac{6.01 \: \text{kJ}}{1 \: \text{mol}} = 12.0 \: \text{kJ}\nonumber \]
- \[\Delta H_3 = 4.18 \: \text{J/g}^\text{o} \text{C} \times 36.04 \: \text{g} \times 100^\text{o} \text{C} \times \frac{1 \: \text{kJ}}{1000 \: \text{kJ}} = 15.1 \: \text{kJ}\nonumber \]
- \[\Delta H_4 = 2.00 \: \text{mol} \times \frac{40.7 \: \text{kJ}}{1 \: \text{mol}} = 81.4 \: \text{kJ}\nonumber \]
- \[\Delta H_5 = 1.87 \: \text{J/g}^\text{o} \text{C} \times 36.04 \: \text{g} \times 40^\text{o} \text{C} \times \frac{1 \: \text{kJ}}{1000 \: \text{J}} = 2.70 \: \text{kJ}\nonumber \]
\[\Delta H_\text{total} = \Delta H_1 + \Delta H_2 + \Delta H_3 + \Delta H_4 + \Delta H_5 = 113.4 \: \text{kJ}\nonumber \]
Paso 3: Piensa en tu resultado.
El calor total absorbido a medida que el hielo\(-30^\text{o} \text{C}\) se calienta a vapor a\(140^\text{o} \text{C}\) es\(133.4 \: \text{kJ}\). La mayor absorción de calor se produce durante la vaporización del agua líquida.

