21.3: Ácidos de Arrhenius
- Page ID
- 70628
Venus es el planeta más cercano a la Tierra, pero tiene un ambiente muy diferente y hostil. Tiene una temperatura superficial que promedia alrededor\(450^\text{o} \text{C}\). La atmósfera está compuesta por dióxido de carbono, pero nubes de ácido sulfúrico se mueven a través de la atmósfera superior, ayudando a crear las condiciones extremadamente hostiles. Debido a estas condiciones, Venus no es un lugar que quieras visitar de vacaciones.
Ácidos de Arrhenius
El químico sueco Svante Arrhenius (1859-1927) fue el primero en proponer una teoría para explicar el comportamiento observado de ácidos y bases. Por su capacidad para conducir una corriente, sabía que tanto los ácidos como las bases contenían iones en solución. Un ácido de Arrhenius es un compuesto que se ioniza para producir iones de hidrógeno\(\left( \ce{H^+} \right)\) en solución acuosa.
Los ácidos son compuestos moleculares con átomos de hidrógeno ionizables. Solo los átomos de hidrógeno que forman parte de un enlace covalente altamente polar son ionizables. \(\left( \ce{HCl} \right)\)El cloruro de hidrógeno es un gas a temperatura ambiente y bajo presión normal. El\(\ce{H-Cl}\) enlace en el cloruro de hidrógeno es un enlace polar. El átomo de hidrógeno es deficiente en electrones debido a la mayor electronegatividad del átomo de cloro. En consecuencia, el átomo de hidrógeno es atraído por el único par de electrones en una molécula de agua cuando\(\ce{HCl}\) se disuelve en agua. El resultado es que el\(\ce{H-Cl}\) enlace se rompe, quedando ambos electrones de unión con el\(\ce{Cl}\), formando un ion cloruro. El\(\ce{H^+}\) ion se une a la molécula de agua, formando un ion poliatómico llamado ion hidronio. El ion hidronio se\(\left( \ce{H_3O^+} \right)\) puede considerar como una molécula de agua con un ion de hidrógeno extra unido.
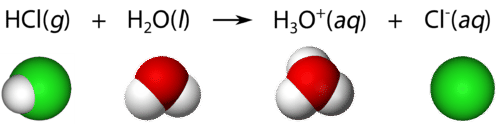
Las ecuaciones que muestran la ionización de un ácido en agua se simplifican frecuentemente omitiendo la molécula de agua:
\[\ce{HCl} \left( g \right) \rightarrow \ce{H^+} \left( aq \right) + \ce{Cl^-} \left( aq \right)\nonumber \]
Esto no es más que una simplificación de la ecuación anterior, pero es de uso común. Cualquier ion hidrógeno en una solución acuosa se unirá a moléculas de agua como iones hidronio.
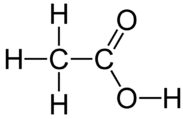
No todos los átomos de hidrógeno en los compuestos moleculares son ionizables. En el metano\(\left( \ce{CH_4} \right)\), los átomos de hidrógeno están unidos covalentemente al carbono en enlaces que solo son ligeramente polares. Los átomos de hidrógeno no son capaces de ionizar, y el metano no tiene propiedades ácidas. El ácido acético\(\left( \ce{CH_3COOH} \right)\) pertenece a una clase de ácidos llamados ácidos orgánicos. Hay cuatro átomos de hidrógeno en la molécula, pero sólo el hidrógeno que está unido a un átomo de oxígeno es ionizable.
La siguiente tabla enumera algunos de los ácidos más comunes:
| Tabla\(\PageIndex{1}\): Ácidos comunes | |
|---|---|
| \ (\ PageIndex {1}\): Ácidos Comunes” style="vertical-align:middle; "> Nombre ácido | Fórmula |
| \ (\ PageIndex {1}\): Ácidos comunes” style="vertical-align:middle; ">Ácido clorhídrico | \(\ce{HCl}\) |
| \ (\ PageIndex {1}\): Ácidos comunes” style="vertical-align:middle; ">Ácido nítrico | \(\ce{HNO_3}\) |
| \ (\ PageIndex {1}\): Ácidos comunes” style="vertical-align:middle; ">Ácido sulfúrico | \(\ce{H_2SO_4}\) |
| \ (\ PageIndex {1}\): Ácidos comunes” style="vertical-align:middle; ">Ácido fosfórico | \(\ce{H_3PO_4}\) |
| \ (\ PageIndex {1}\): Ácidos comunes” style="vertical-align:middle; ">Ácido acético | \(\ce{CH_3COOH}\) |
| \ (\ PageIndex {1}\): Ácidos comunes” style="vertical-align:middle; ">Ácido hipocloroso | \(\ce{HClO}\) |
Un ácido monoprótico es un ácido que contiene solo un hidrógeno ionizable. El ácido clorhídrico y el ácido acético son ácidos monopróticos. Un ácido poliprótico es un ácido que contiene múltiples hidrógenos ionizables. Los ácidos polipróticos más comunes son dipróticos (como\(\ce{H_2SO_4}\)) o tripróticos (como\(\ce{H_3PO_4}\)).
Resumen
- Un ácido de Arrhenius es un compuesto que se ioniza para producir iones de hidrógeno\(\left( \ce{H^+} \right)\) en solución acuosa.
- Se dan ejemplos de ácidos de Arrhenius.

