21.4: Bases Arrhenius
- Page ID
- 70677
El hidróxido de sodio es un químico versátil. Se puede utilizar para fines tan mundanos como limpiar desagües obstruidos. Varias preparaciones comerciales contienen hidróxido de sodio para este propósito. También tiene una serie de aplicaciones en el campo de procesamiento de alimentos. El helado se espesa usando\(\ce{NaOH}\). Si las aceitunas se remojan en una solución que contiene hidróxido de sodio y otros productos químicos, las aceitunas se vuelven negras. Los pretzels blandos se hacen masticables mediante la aplicación de hidróxido de sodio a los alimentos. Este compuesto ha sido ampliamente utilizado en la síntesis de plásticos, para el grabado de aluminio, para la eliminación de pintura, y se emplea en el descorvado de ganado.
Bases Arrhenius
Una base de Arrhenius es un compuesto que se ioniza para producir iones hidróxido\(\left( \ce{OH^-} \right)\) en solución acuosa. La siguiente tabla enumera varias de las bases más comunes.
| Nombre Base | Fórmula |
|---|---|
| Hidróxido de sodio | \(\ce{NaOH}\) |
| Hidróxido de potasio | \(\ce{KOH}\) |
| Hidróxido de magnesio | \(\ce{Mg(OH)_2}\) |
| Hidróxido de calcio | \(\ce{Ca(OH)_2}\) |
Todas las bases listadas en la tabla son sólidas a temperatura ambiente. Al disolverse en agua, cada uno se disocia en un catión metálico y el ion hidróxido.
\[\ce{NaOH} \left( s \right) \rightarrow \ce{Na^+} \left( aq \right) + \ce{OH^-} \left( aq \right)\nonumber \]
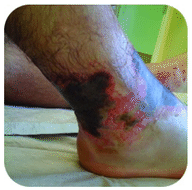
El hidróxido de sodio es una sustancia muy cáustica también conocida como lejía. La lejía se utiliza como un limpiador riguroso y es un ingrediente en la fabricación de jabones. Se debe tener cuidado con bases fuertes como el hidróxido de sodio, ya que la exposición puede provocar quemaduras graves (ver figura a continuación).
El sodio pertenece al grupo de elementos llamados los metales alcalinos. Una solución alcalina es otro nombre para una solución que es básica. Todos los metales alcalinos reaccionan fácilmente con el agua para producir el hidróxido metálico y el gas hidrógeno. Las soluciones resultantes son básicas.
\[2 \ce{K} \left( s \right) + 2 \ce{H_2O} \left( l \right) \rightarrow 2 \ce{KOH} \left( aq \right) + \ce{H_2} \left( g \right)\nonumber \]
Las bases que consisten en un catión de metal alcalino y el anión hidróxido son todas muy solubles en agua. Los compuestos de los metales del Grupo 2 (los metales alcalinotérreos) también son básicos. Sin embargo, estos compuestos generalmente no son tan solubles en agua. Por lo tanto, las reacciones de disociación para estos compuestos se muestran como reacciones de equilibrio:
\[\ce{Mg(OH)_2} \left( s \right) \overset{\ce{H_2O}}{\rightleftharpoons} \ce{Mg^{2+}} \left( aq \right) + 2 \ce{OH^-} \left( aq \right)\nonumber \]
Estos hidróxidos relativamente insolubles fueron algunos de los compuestos discutidos en el contexto de la constante del producto de solubilidad\(\left( K_\text{sp} \right)\). La solubilidad del hidróxido de magnesio es\(0.0084 \: \text{g}\) por litro de agua a\(25^\text{o} \text{C}\). Debido a su baja solubilidad, el hidróxido de magnesio no es tan peligroso como el hidróxido de sodio. De hecho, el hidróxido de magnesio es el ingrediente activo en un producto llamado leche de magnesia, que se utiliza como antiácido o laxante suave.
Resumen
- La base de Arrhenius es un compuesto que se ioniza para producir iones hidróxido\(\left( \ce{OH^-} \right)\) en solución acuosa.
- Se dan ejemplos de bases de Arrhenius.

