21.7: Ácidos y bases de Lewis
- Page ID
- 70653
Las ideas en la ciencia no permanecen estáticas. Un descubrimiento se basa en otro. El concepto de ácidos y bases ha crecido desde las ideas fundamentales de Arrhenius hasta Brønsted-Lowry y Lewis. Cada paso se suma a nuestra comprensión del mundo circundante y hace que el “panorama general” sea aún más grande.
Ácidos y bases de Lewis
Gilbert Lewis (1875-1946) propuso una tercera teoría de ácidos y bases que es aún más general que las teorías de Arrhenius o Brønsted-Lowry. Un ácido de Lewis es una sustancia que acepta un par de electrones para formar un enlace covalente. Una base de Lewis es una sustancia que dona un par de electrones para formar un enlace covalente. Entonces, una reacción ácido-base de Lewis está representada por la transferencia de un par de electrones de una base a un ácido. Un ion hidrógeno, que carece de electrones, acepta un par de electrones. Es un ácido bajo las definiciones de Brønsted-Lowry y Lewis. El amoníaco consiste en un átomo de nitrógeno como átomo central con un par solitario de electrones. La reacción entre el amoníaco y el ión hidrógeno se puede representar como se muestra en la siguiente figura.
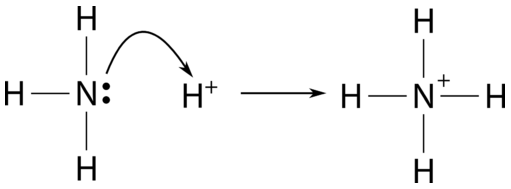
El par solitario en el átomo de nitrógeno se transfiere al ión hidrógeno, haciendo que la\(\ce{NH_3}\) base a Lewis mientras que la\(\ce{H^+}\) es un ácido de Lewis.
Algunas reacciones que no califican como reacciones ácido-base bajo las otras definiciones lo hacen bajo solo la definición de Lewis. Un ejemplo es la reacción del amoníaco con trifluoruro de boro.
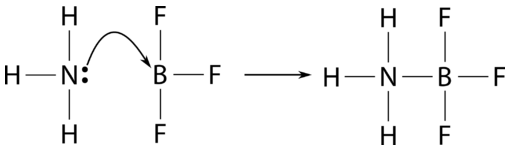
El trifluoruro de boro es el ácido de Lewis, mientras que el amoníaco vuelve a ser la base de Lewis. Como no hay ningún ion hidrógeno involucrado en esta reacción, califica como reacción ácido-base solo bajo la definición de Lewis. La siguiente tabla resume las tres teorías ácido-base.
| Tabla\(\PageIndex{1}\): Definiciones ácido-base | ||
|---|---|---|
| \ (\ PageIndex {1}\): Definiciones ácido-base” style="vertical-align:middle; "> Tipo | Ácido | Base |
| \ (\ PageIndex {1}\): Definiciones ácido-base” style="vertical-align:middle; ">Arrhenius | \(\ce{H^+}\)iones en solución | \(\ce{OH^-}\)iones en solución |
| \ (\ PageIndex {1}\): Definiciones ácido-base” style="vertical-align:middle; ">Brønsted-Lowry | \(\ce{H^+}\)donante | \(\ce{H^+}\)aceptor |
| \ (\ PageIndex {1}\): Definiciones ácido-base” style="vertical-align:middle; ">Lewis | aceptor de pares de electrones | donador de pares de electrones |
Resumen
- Un ácido de Lewis es una sustancia que acepta un par de electrones para formar un enlace covalente.
- Una base de Lewis es una sustancia que dona un par de electrones para formar un enlace covalente.
- Se dan ejemplos de ácidos y bases de Lewis.

