21.6: Reacciones Ácido-Base de Lowry de Brønsted-
- Page ID
- 70629
El dios romano Jano era considerado el dios de las puertas, las puertas, los comienzos y los finales. Se le retrata con dos caras, mirando en dos direcciones a la vez. Jano habría estado en una buena posición para mirar las reacciones ácido-base que vemos en este concepto, ya que son reacciones de equilibrio que involucran dos formas diferentes tanto de ácidos como de bases.
Reacciones ácido-base bajas de Brønsted-Lowry
Una reacción ácido-base, según la definición de Brønsted-Lowry, es una transferencia de un protón de una molécula o ion a otro. Cuando el amoníaco se disuelve en agua, se somete a la siguiente reacción reversible.
\[\begin{array}{ccccccc} \ce{NH_3} \left( aq \right) & + & \ce{H_2O} \left( l \right) & \rightleftharpoons & \ce{NH_4^+} \left( aq \right) & + & \ce{OH^-} \left( aq \right) \\ \text{base} & & \text{acid} & & \text{acid} & & \text{base} \end{array}\nonumber \]
En esta reacción, la molécula de agua está donando un protón a la molécula de amoníaco. Los productos resultantes son el ion amonio y el ion hidróxido. El agua está actuando como un ácido de Brønsted-Lowry, mientras que el amoníaco actúa como base de Brønsted-Lowry. El ion hidróxido que se produce provoca que la solución sea básica.
También podemos considerar la reacción inversa en la ecuación anterior. En esa reacción, el ion amoníaco dona un protón al ion hidróxido. El ion amonio es un ácido de Brønsted-Lowry, mientras que el ion hidróxido es una base de Brønsted-Lowry. La mayoría de las reacciones ácido-base de Brønsted-Lowry se pueden analizar de esta manera. Un ácido y una base son reactivos, y un ácido y una base son productos.
En la reacción anterior, el agua actuó como un ácido, lo que puede parecer un poco inesperado. El agua también puede actuar como base en una reacción ácido-base de Brønsted-Lowry, siempre y cuando reaccione con una sustancia que sea un mejor donante de protones. A continuación se muestra la reacción del agua con el ión sulfato de hidrógeno.
\[\begin{array}{ccccccc} \ce{HSO_4^-} \left( aq \right) & + & \ce{H_2O} \left( l \right) & \rightleftharpoons & \ce{H_3O^+} \left( aq \right) & + & \ce{SO_4^{2-}} \left( aq \right) \\ \text{acid} & & \text{base} & & \text{acid} & & \text{base} \end{array}\nonumber \]
Entonces, el agua es capaz de ser un ácido o una base, una característica llamada anfoterismo. Una sustancia anfótera es aquella que es capaz de actuar como un ácido o una base donando o aceptando iones de hidrógeno.
Ácidos y Bases Conjugados
Cuando una sustancia que está actuando como ácido de Brønsted-Lowry dona su protón, se convierte en una base en la reacción inversa. En la reacción anterior, el ion sulfato de hidrógeno\(\left( \ce{HSO_4^-} \right)\) dona un protón al agua y se convierte en un ion sulfato\(\left( \ce{SO_4^{2-}} \right)\). Los\(\ce{HSO_4^-}\) y los\(\ce{SO_4^{2-}}\) están unidos entre sí por la presencia o ausencia del\(\ce{H^+}\) ion. Un par ácido base conjugado es un par de sustancias relacionadas por la pérdida o ganancia de un solo ion hidrógeno. Un ácido conjugado es la partícula producida cuando una base acepta un protón. El ion sulfato de hidrógeno es el ácido conjugado del ion sulfato. Una base conjugada es la partícula producida cuando un ácido dona un protón. El ion sulfato es la base conjugada del ion sulfato de hidrógeno.
En la reacción ilustrada a continuación, el agua sirve tanto como ácido como base simultáneamente. Una molécula de agua sirve como ácido y dona un protón. La otra molécula de agua funciona como base aceptando el protón.
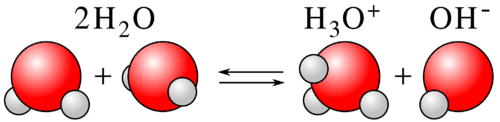
Una reacción ácido-base típica de Brønsted-Lowry contiene dos pares ácido-base conjugados, como se muestra a continuación.
\[\ce{HNO_2} \left( aq \right) + \ce{PO_4^{3-}} \left( aq \right) \rightleftharpoons \ce{NO_2^-} \left( aq \right) + \ce{HPO_4^{2-}} \left( aq \right)\nonumber \]
Un par ácido base conjugado es\(\ce{NHO_2}\)/\(\ce{NO_2^-}\), mientras que el otro par es\(\ce{HPO_4^{2-}}\)/\(\ce{PO_4^{3-}}\).
Resumen
- Una reacción ácido-base, según la definición de Brønsted-Lowry, es una transferencia de un protón de una molécula o ion a otro.
- Un par ácido base conjugado es un par de sustancias relacionadas por la pérdida o ganancia de un solo ion hidrógeno.
- Un ácido conjugado es la partícula producida cuando una base acepta un protón.
- Una base conjugada es la partícula producida cuando un ácido dona un protón.
- Se dan ejemplos de pares ácido-base conjugados.

