3.4: Masas de átomos y moléculas
- Page ID
- 74814
- Expresar las masas de átomos y moléculas.
Debido a que la materia se define como cualquier cosa que tenga masa y ocupe espacio, no debería sorprender saber que los átomos y las moléculas tienen masa.
Los átomos y moléculas individuales, sin embargo, son muy pequeños, y las masas de átomos y moléculas individuales también son muy pequeñas. Para los objetos macroscópicos, utilizamos unidades como gramos y kilogramos para indicar sus masas, pero estas unidades son demasiado grandes para describir cómodamente las masas de átomos y moléculas individuales. Se necesita otra escala.
Unidad de masa atómica
La unidad de masa atómica (u; algunos textos usan amu, pero este estilo más antiguo ya no es aceptado) se define como una doceava parte de la masa de un átomo de carbono-12, un isótopo de carbono que tiene seis protones y seis neutrones en su núcleo. Por esta escala, la masa de un protón es 1.00728 u, la masa de un neutrón es 1.00866 u, y la masa de un electrón es 0.000549 u No habrá mucho error si estimas la masa de un átomo simplemente contando el número total de protones y neutrones en el núcleo (es decir, identifica su número de masa) e ignora los electrones. Así, la masa de carbono-12 es de aproximadamente 12 u, la masa de oxígeno-16 es de aproximadamente 16 u, y la masa de uranio-238 es de aproximadamente 238 u. Las masas más exactas se encuentran en referencias científicas, por ejemplo, la masa exacta de uranio-238 es de 238.050788 u, por lo que puede ver que no estamos muy lejos usando el valor de número entero como el masa del átomo.
¿Cuál es la masa de un elemento? Esto es algo más complicado porque la mayoría de los elementos existen como una mezcla de isótopos, cada uno de los cuales tiene su propia masa. Así, aunque es fácil hablar de la masa de un átomo, al hablar de la masa de un elemento, debemos tomar en cuenta la mezcla isotópica.
Masa atómica
La masa atómica de un elemento es un promedio ponderado de las masas de los isótopos que componen un elemento. ¿A qué nos referimos con un promedio ponderado? Bueno, considera un elemento que consta de dos isótopos, 50% con masa 10 u y 50% con masa 11 u Se encuentra un promedio ponderado multiplicando cada masa por su ocurrencia fraccionada (en forma decimal) y luego sumando todos los productos. La suma es el promedio ponderado y sirve como la masa atómica formal del elemento. En este ejemplo, tenemos lo siguiente:
| 0.50 × 10 u | = 5.0 u |
|---|---|
| 0.50 × 11 u | = 5.5 u |
| Suma | = 10.5 u = la masa atómica de nuestro elemento |
Nótese que ningún átomo en nuestro elemento hipotético tiene una masa de 10.5 u; más bien, esa es la masa promedio de los átomos, ponderada por su porcentaje de ocurrencia.
Este ejemplo es similar a un elemento real. El boro existe como aproximadamente 20% boro-10 (cinco protones y cinco neutrones en los núcleos) y aproximadamente 80% boro-11 (cinco protones y seis neutrones en los núcleos). La masa atómica del boro se calcula de manera similar a lo que hicimos para nuestro hipotético ejemplo, pero los porcentajes son diferentes:
| 0.20 × 10 u | = 2.0 u |
|---|---|
| 0.80 × 11 u | = 8.8 u |
| Suma | = 10.8 u = la masa atómica del boro |
Así, utilizamos 10.8 u para la masa atómica del boro.
Prácticamente todos los elementos existen como mezclas de isótopos, por lo que las masas atómicas pueden variar significativamente de números enteros. Tabla\(\PageIndex{1}\) enumera las masas atómicas de algunos elementos. Las masas atómicas en la Tabla\(\PageIndex{1}\) se enumeran a tres decimales cuando sea posible, pero en la mayoría de los casos, solo se necesitan uno o dos decimales. Tenga en cuenta que muchas de las masas atómicas, especialmente las más grandes, no están muy cerca de números enteros. Esto es, en parte, el efecto de un número creciente de isótopos a medida que los átomos aumentan de tamaño. (El número de registro es de 10 isótopos para el estaño.)
| Nombre del elemento | Masa atómica (u) | Nombre del elemento | Masa atómica (u) |
|---|---|---|---|
| Aluminio | 26.981 | Molibdeno | 95.94 |
| Argón | 39.948 | Neón | 20.180 |
| Arsénico | 74.922 | Níquel | 58.693 |
| Bario | 137.327 | Nitrógeno | 14.007 |
| Berilio | 9.012 | Oxígeno | 15.999 |
| Bismuto | 208.980 | Palladium | 106.42 |
| Boro | 10.811 | Fosforo | 30.974 |
| Bromo | 79.904 | Platino | 195.084 |
| Calcio | 40.078 | Potasio | 39.098 |
| Carbono | 12.011 | Radium | n/a |
| Cloro | 35.453 | Radón | n/a |
| Cobalto | 58.933 | Rubidio | 85.468 |
| Cobre | 63.546 | Escandio | 44.956 |
| Flúor | 18.998 | Selenio | 78.96 |
| Galio | 69.723 | Silicio | 28.086 |
| Germanio | 72.64 | Plata | 107.868 |
| Oro | 196.967 | Sodio | 22.990 |
| Helio | 4.003 | Estroncio | 87.62 |
| Hidrógeno | 1.008 | Azufre | 32.065 |
| Yodo | 126.904 | Tantalio | 180.948 |
| Iridio | 192.217 | Estaño | 118.710 |
| Hierro | 55.845 | Titanio | 47.867 |
| Criptón | 83.798 | Tungsteno | 183.84 |
| Plomo | 207.2 | Uranio | 238.029 |
| Litio | 6.941 | Xenon | 131.293 |
| Magnesio | 24.305 | Zinc | 65.409 |
| Manganeso | 54.938 | Circonio | 91.224 |
| Mercurio | 200.59 | Molibdeno | 95.94 |
| Nota: La masa atómica se da a tres decimales, si se conoce. | |||
Masa molecular
Ahora que entendemos que los átomos tienen masa, es fácil extender el concepto a la masa de moléculas. La masa molecular es la suma de las masas de los átomos en una molécula. Esto puede parecer una extensión trivial del concepto, pero es importante contar el número de cada tipo de átomo en la fórmula molecular. Además, aunque cada átomo en una molécula es un isótopo particular, utilizamos el promedio ponderado, o masa atómica, para cada átomo en la molécula.
Por ejemplo, si tuviéramos que determinar la masa molecular del trióxido de dinitrógeno, N 2 O 3, necesitaríamos agregar la masa atómica de nitrógeno dos veces con la masa atómica de oxígeno tres veces:
| 2 N masas = 2 × 14.007 u | = 28.014 u |
|---|---|
| 3 O masas = 3 × 15.999 u | = 47.997 u |
| Total | = 76.011 u = la masa molecular de N 2 O 3 |
No estaríamos muy lejos si limitáramos nuestros números a uno o incluso dos decimales.
¿Cuál es la masa molecular de cada sustancia?
- \(\ce{NBr3}\)
- \(\ce{C2H6}\)
Solución
Añadir una masa atómica de nitrógeno y tres masas atómicas de bromo:
| Masa de 1 N | = 14.007 u |
|---|---|
| Masas de 3 Br = 3 × 79.904 u | = 239.712 u |
| Total | = 253.719 u = la masa molecular de NBr 3 |
Añadir dos masas atómicas de carbono y seis masas atómicas de hidrógeno:
| 2 masas C = 2 × 12.011 u | = 24.022 u |
|---|---|
| 6 H masas = 6 × 1.008 u | = 6.048 u |
| Total | = 30.070 u = la masa molecular de C 2 H 6 |
El compuesto\(\ce{C2H6}\) también tiene un nombre común: etano.
¿Cuál es la masa molecular de cada sustancia?
- \(\ce{SO2}\)
- \(\ce(PF3}\)
- Contestar a
-
64.063 u
- Respuesta b
-
87.968 u
El 20 de marzo de 1995, el grupo terrorista japonés Aum Shinrikyo (sánscrito para “Verdad Suprema”) liberó algo de gas sarín en el sistema del metro de Tokio; doce personas murieron, y miles resultaron heridas (Figura\(\PageIndex{2a}\)). El sarín (fórmula molecular\(\ce{C4H10FPO2}\)) es una toxina nerviosa que se sintetizó por primera vez en 1938. Es considerada como una de las toxinas más mortales conocidas, estimadas en unas 500 veces más potentes que el cianuro. Científicos e ingenieros que estudian la propagación de armas químicas como el sarín (sí, hay tales científicos) les gustaría tener un químico similar menos peligroso para estudiar, de hecho uno que no sea tóxico, por lo que ellos mismos no están en riesgo.
El hexafluoruro de azufre se utiliza como compuesto modelo para el sarín. \(\ce{SF6}\)(un modelo molecular del que se muestra Figura\(\PageIndex{2b}\)) tiene una masa molecular similar (aproximadamente 146 u) a la del sarín (aproximadamente 140 u), por lo que tiene propiedades físicas similares en la fase vapor. El hexafluoruro de azufre también es muy fácil de detectar con precisión, incluso a niveles bajos, y no es una parte normal de la atmósfera, por lo que hay poco potencial de contaminación de fuentes naturales. En consecuencia, también\(\ce{SF6}\) se utiliza como trazador aéreo para sistemas de ventilación en edificios. Es no tóxico y muy químicamente inerte, por lo que los trabajadores no tienen que tomar precauciones especiales que no sean estar atentos a la asfixia.
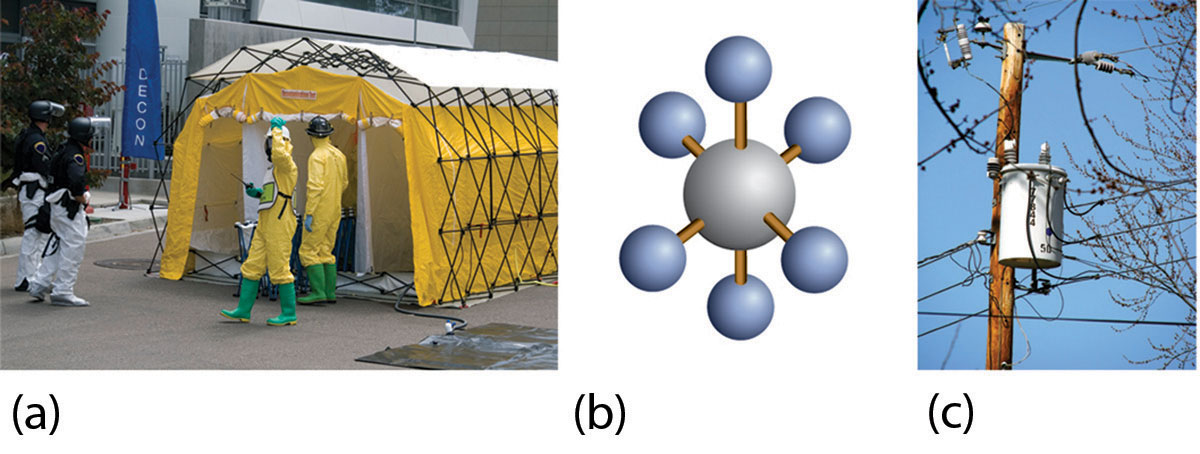
El hexafluoruro de azufre también tiene otro uso interesante: un supresor de chispas en equipos eléctricos de alto voltaje. El\(\ce{SF6}\) gas de alta presión se utiliza en lugar de los aceites más antiguos que pueden tener contaminantes que no son respetuosos con el medio ambiente (Figura\(\PageIndex{2c}\)).
Claves para llevar
- La unidad de masa atómica (u) es una unidad que describe las masas de átomos y moléculas individuales.
- La masa atómica es el promedio ponderado de las masas de todos los isótopos de un elemento.
- La masa molecular es la suma de las masas de los átomos en una molécula.


