5.E: La estequiometría y el topo (Ejercicios)
- Page ID
- 74818
5.1: Estequiometría
- Piensa en la receta del bizcocho. ¿Qué posibles factores de conversión se pueden construir relacionando los componentes de la receta?
- Piensa en la receta de panqueques. ¿Qué posibles factores de conversión se pueden construir relacionando los componentes de la receta?
- Cuáles son todos los factores de conversión que se pueden construir a partir de la reacción química equilibrada:\[\ce{2H2(g) + O2(g) → 2H2O(ℓ)}?\]
- ¿Cuáles son todos los factores de conversión que se pueden construir a partir de la reacción química balanceada N 2 (g) + 3H 2 (g) → 2NH 3 (g)?
- Dada la ecuación química: Na (s) + H 2 O (l) → NaOH (aq) + H 2 (g)
- Equilibrar la ecuación.
- ¿Cuántas moléculas de H 2 se producen cuando reaccionan 332 átomos de Na?
- Dada la ecuación química: S (s) + O 2 (g) → SO 3 (g)
- Equilibrar la ecuación.
- ¿Cuántas moléculas de O 2 se necesitan cuando reaccionan 38 átomos de S?
- Para la ecuación química equilibrada:
6H + (aq) + 2MnO 4 − (aq) + 5H 2 O 2 (l) → 2Mn 2+ (aq) + 5O 2 (g) + 8H 2 O (l )
¿cuántas moléculas de H 2 O se producen cuando reaccionan 75 moléculas de H 2 O 2?
-
Para la reacción química equilibrada
2C 6 H 6 (l) + 15O 2 (g) → 12CO 2 (g) + 6H 2 O (l)¿cuántas moléculas de CO 2 se producen cuando reaccionan 56 moléculas de C 6 H 6?
-
Dada la ecuación química equilibrada
Fe 2 O 3 (s) + 3SO 3 (g) → Fe 2 (SO 4) 3¿cuántas moléculas de Fe 2 (SO 4) 3 se producen si se hacen reaccionar 321 átomos de S?
-
Para la ecuación química equilibrada
CuO (s) + H 2 S (g) → CuS + H 2 O (l)¿cuántas moléculas de CU se forman si reaccionan 9,044 átomos de H?
-
Para la ecuación química equilibrada
Fe 2 O 3 (s) + 3SO 3 (g) → Fe 2 (SO 4) 3supongamos que necesitamos hacer 145,000 moléculas de Fe 2 (SO 4) 3. ¿Cuántas moléculas de SO 3 necesitamos?
- Una forma de hacer hexafluoruro de azufre es hacer reaccionar tioformaldehído, CH 2 S, con flúor elemental:
CH 2 S + 6F 2 → CF 4 + 2HF + SF 6
Si se necesitan 45,750 moléculas de SF 6, ¿cuántas moléculas de F 2 se requieren?
- Construir los tres factores de conversión independientes posibles para estas dos reacciones:
- 2H 2 + O 2 → 2H 2 O
- H 2 + O 2 → H 2 O 2
¿Por qué son diferentes las relaciones entre H 2 y O 2?
Los factores de conversión son diferentes porque las estequiometrías de las reacciones químicas equilibradas son diferentes.
- Construir los tres factores de conversión independientes posibles para estas dos reacciones:
- 2Na + Cl 2 → 2NaCl
- 4Na + 2Cl 2 → 4NaCl
¿Qué similitudes, si las hay, existen en los factores de conversión de estas dos reacciones?
- \[\frac{1\, pound\, butter}{1\, pound\, flour}\]o\[\frac{1\, pound\, sugar}{1\, pound\, eggs}\] son dos factores de conversión que se pueden construir a partir de la receta del bizcocho. También son posibles otros factores de conversión. 1 libra de mantequilla 1 libra de harina
-
-
2 molecules H 2 1 molecule O 2 2 molecules H 2 1 molecule O 2 -
-
-
2Na (s) + 2H 2 O (l) → 2NaOH (ac) + H 2 (g)
-
166 moléculas
-
-
-
120 moléculas
-
-
107 moléculas
-
-
435,000 moléculas
-
-
- \[\frac{2\, molecules\, H_{2}}{1\, molecule\, O_{2}}\ , \frac{1\, molecule\, O_{2}}{2\, molecules\, H_{2}O}\ , \frac{2\, molecules\, H_{2}}{2\, molecules\, H_{2}O}\]
- \[\frac{1\, molecules\, H_{2}}{1\, molecule\, O_{2}}\ , \frac{1\, molecule\, O_{2}}{2\, molecules\, H_{2}O_{2}}\ , \frac{1\, molecule\, H_{2}}{1\, molecule\, H_{2}O_{2}}\]
5.2: El Topo
- ¿Cuántos átomos están presentes en 4.55 mol de Fe?
- ¿Cuántos átomos están presentes en 0.0665 mol de K?
- ¿Cuántas moléculas están presentes en 2.509 mol de H 2 S?
- ¿Cuántas moléculas están presentes en 0.336 mol de acetileno (C 2 H 2)?
- ¿Cuántos moles están presentes en 3.55 × 10 átomos de 24 Pb?
- ¿Cuántos moles están presentes en 2.09 × 10 22 átomos de Ti?
- ¿Cuántos moles están presentes en las moléculas 1.00 × 10 23 PF 3?
- ¿Cuántos moles están presentes en 5.52 × 10 25 moléculas de penicilina?
- Determinar la masa molar de cada sustancia.
- Si
- SiH 4
- K 2 O
- Determinar la masa molar de cada sustancia.
- Cl 2
- SecL 2
- Ca (C 2 H 3 O 2) 2
- Determinar la masa molar de cada sustancia.
- Al
- Al 2 O 3
- COCl 3
- Determinar la masa molar de cada sustancia.
- O 3
- NaI
- C 12 H 22 O 11
- ¿Cuál es la masa de 4.44 mol de Rb?
- ¿Cuál es la masa de 0.311 mol de Xe?
- ¿Cuál es la masa de 12.34 mol de Al 2 (SO 4) 3?
- ¿Cuál es la masa de 0.0656 mol de PbCl 2?
- ¿Cuántos moles están presentes en 45.6 g de CO?
- ¿Cuántos moles están presentes en 0.00339 g de LiF?
- ¿Cuántos moles están presentes en 1.223 g de SF 6?
- ¿Cuántos moles están presentes en 48.8 g de BaCo 3?
- ¿Cuántos moles están presentes en 54.8 mL de mercurio si la densidad del mercurio es 13.6 g/mL?
- ¿Cuántos moles están presentes en 56.83 mL de O 2 si la densidad de O 2 es 0.00133 g/mL?
RESPUESTAS
- 2.74 × 10 24 átomos
-
-
1.511 × 10 24 moléculas
-
-
5.90 mol
-
-
0.166 mol
-
-
-
28.086 g
-
32.118 g
-
94.195 g
-
-
-
-
26.981 g
-
101.959 g
-
165.292 g
-
-
-
379 g
-
-
4,222 g
-
-
1.63 mol
-
-
0.008374 mol
-
-
3.72 mol
5.3: El Mole en las Reacciones Químicas
- Expresar en términos molares lo que significa esta ecuación química: CH 4 + 2O 2 → CO 2 + 2H 2 O
-
Expresar en términos molares lo que significa esta ecuación química.
Na 2 CO 3 + 2HCl → 2NaCl + H 2 O + CO 2 -
¿Cuántas moléculas de cada sustancia están involucradas en la ecuación del Ejercicio 1 si se interpreta en términos de moles?
-
¿Cuántas moléculas de cada sustancia están involucradas en la ecuación del Ejercicio 2 si se interpreta en términos de moles?
-
Para la ecuación química
2C 2 H 6 + 7O 2 → 4CO 2 + 6H 2 O¿Qué equivalentes puedes escribir en términos de moles? Usa el letrero ⇔.
-
Para la ecuación química
2Al + 3Cl 2 → 2AlCl 3¿Qué equivalentes puedes escribir en términos de moles? Usa el letrero ⇔.
-
Escribir la reacción química equilibrada para la combustión de C 5 H 12 (los productos son CO 2 y H 2 O) y determinar cuántos moles de H 2 O se forman cuando 5.8 mol de O 2 reaccionan.
-
Escribir la reacción química equilibrada para la formación de Fe 2 (SO 4) 3 a partir de Fe 2 O 3 y SO 3 y determinar cuántos moles de Fe 2 (SO 4) 3 se forman cuando se hacen reaccionar 12.7 mol de SO 3.
-
Para la ecuación química equilibrada
3Cu (s) + 2NO 3 − (aq) + 8H + (aq) → 3Cu 2+ (aq) + 4H 2 O (l) + 2NO (g)¿cuántos moles de Cu 2+ se forman cuando se hacen reaccionar 55.7 moles de H +?
-
Para la ecuación química equilibrada
Al (s) + 3Ag + (aq) → Al 3+ (aq) + 3Ag (s)¿cuántos moles de Ag se producen cuando reaccionan 0.661 mol de Al?
-
Para la reacción química equilibrada
4NH 3 (g) + 5O 2 (g) → 4NO (g) + 6H 2 O (l)¿cuántos moles de H 2 O se producen cuando reaccionan 0.669 mol de NH 3?
-
Para la reacción química equilibrada
4NaOH (ac) + 2S (s) + 3O 2 (g) → 2Na 2 SO 4 (aq) + 2H 2 O (l)¿cuántos moles de Na 2 SO 4 se forman cuando reaccionan 1.22 mol de O 2?
-
Para la reacción química equilibrada
4KO 2 (s) + 2CO 2 (g) → 2K 2 CO 3 (s) + 3O 2 (g)determinar el número de moles de ambos productos formados cuando reaccionan 6.88 mol de KO 2.
- Para la reacción química equilibrada
RESPUESTAS
- Un mol de CH 4 reacciona con 2 mol de O 2 para hacer 1 mol de CO 2 y 2 mol de H 2 O.
-
-
6.022 × 10 23 moléculas de CH 4, 1.2044 × 10 24 moléculas de O 2, 6.022 × 10 23 moléculas de CO 2, y 1.2044 × 10 24 moléculas de H 2 O
-
-
2 mol de C 2 H 6 ⇔ 7 mol de O 2 ⇔ 4 mol de CO 2 ⇔ 6 mol de H 2 O
-
-
C 5 H 12 + 8O 2 → 5CO 2 + 6H 2 O; 4.4 mol
-
-
20.9 mol
-
-
1.00 mol
-
-
3.44 mol de K 2 CO 3; 5.16 mol de O 2
5.4: Cálculos de Masa Mole-Masa y Masa
- ¿Qué masa de CO 2 se produce por la combustión de 1.00 mol de CH 4? CH 4 (g) + 2O 2 (g) → CO 2 (g) + 2H 2 O (l)
-
¿Qué masa de H 2 O se produce por la combustión de 1.00 mol de CH 4?
CH 4 (g) + 2O 2 (g) → CO 2 (g) + 2H 2 O (l) -
¿Qué masa de HGo se requiere para producir 0.692 mol de O 2?
2HGo (s) → 2Hg (l) + O 2 (g) -
¿Qué masa de NaHCO 3 se necesita para producir 2.659 mol de CO 2?
2NaHCO 3 (s) → Na 2 CO 3 (s) + H 2 O (l) + CO 2 (g) -
¿Cuántos moles de Al se pueden producir a partir de 10.87 g de Ag?
Al (NO 3) 3 (s) + 3Ag → Al + 3AgnO 3 -
¿Cuántos moles de HCl se pueden producir a partir de 0.226 g de SoCl 2?
SOCl 2 (l) + H 2 O (l) → SO 2 (g) + 2HCl (g) -
¿Cuántos moles de O 2 se necesitan para preparar 1.00 g de Ca (NO 3) 2?
Ca (s) + N 2 (g) + 3O 2 (g) → Ca (NO 3) 2 (s) -
¿Cuántos moles de C 2 H 5 OH se necesitan para generar 106.7 g de H 2 O?
C 2 H 5 OH (l) + 3O 2 (g) → 2CO 2 (g) + 3H 2 O (l) -
¿Qué masa de O 2 se puede generar por la descomposición de 100.0 g de NaClO 3?
2NaClO 3 → 2NaCl (s) + 3O 2 (g) -
¿Qué masa de Li 2 O se necesita para reaccionar con 1,060 g de CO 2?
Li 2 O (aq) + CO 2 (g) → Li 2 CO 3 (aq) -
¿Qué masa de Fe 2 O 3 debe reaccionar para generar 324 g de Al 2 O 3?
Fe 2 O 3 (s) + 2Al (s) → 2Fe (s) + Al 2 O 3 (s) -
¿Qué masa de Fe se genera cuando se hacen reaccionar 100.0 g de Al?
Fe 2 O 3 (s) + 2Al (s) → 2Fe (s) + Al 2 O 3 (s) -
¿Qué masa de MnO 2 se produce cuando se hacen reaccionar 445 g de H 2 O?
H 2 O (l) + 2MnO 4 − (aq) + Br − (aq) → Bro 3 − (aq) + 2MnO 2 (s) + 2OH − (aq) -
¿Qué masa de PbSO 4 se produce cuando reaccionan 29.6 g de H 2 SO 4?
Pb (s) + PbO 2 (s) + 2H 2 SO 4 (aq) → 2PbSO 4 (s) + 2H 2 O (l.) -
Si se forman 83.9 g de ZnO, ¿qué masa de Mn 2 O 3 se forma con él?
Zn (s) + 2MnO 2 (s) → ZnO (s) + Mn 2 O 3 (s) -
Si se hacen reaccionar 14.7 g de NO 2, ¿qué masa de H 2 O reacciona con él?
3NO 2 (g) + H 2 O (l) → 2HNO 3 (aq) + NO (g) -
Si se hacen reaccionar 88.4 g de CH 2 S, ¿qué masa de HF se produce?
CH 2 S + 6F 2 → CF 4 + 2HF + SF 6
- Si se necesitan 100.0 g de Cl 2, ¿qué masa de NaOCl debe reaccionar?
NaOCl + HCl → NaOH + Cl 2
RESPUESTAS
- 44.0 g
-
-
3.00 × 10 2 g
-
-
0.0336 mol
-
-
0.0183 mol
-
-
45.1 g
-
-
507 g
-
-
4.30 × 10 3 g
-
-
163 g
-
-
76.7 g
5.5: Rendimientos
- ¿Cuál es la diferencia entre el rendimiento teórico y el rendimiento real?
-
¿Cuál es la diferencia entre el rendimiento real y el rendimiento porcentual?
-
Un trabajador aísla 2.675 g de SiF 4 después de hacer reaccionar 2.339 g de SiO 2 con HF. ¿Cuáles son el rendimiento teórico y el rendimiento real?
SiO 2 (s) + 4HF (g) → SiF 4 (g) + 2H 2 O (l) -
Un trabajador sintetiza aspirina, C 9 H 8 O 4, de acuerdo con esta ecuación química. Si se hacen reaccionar 12.66 g de C 7 H 6 O 3 y se aíslan 12.03 g de aspirina, ¿cuál es el rendimiento teórico y el rendimiento real?
C 7 H 6 O 3 + C 4 H 6 O 3 → C 9 H 8 O 4 + HC 2 H 3 O 2 -
Un químico descompone 1.006 g de NaHCO 3 y obtiene 0.0334 g de Na 2 CO 3. ¿Cuáles son el rendimiento teórico y el rendimiento real?
2NaHCO 3 (s) → Na 2 CO 3 (s) + H 2 O (l) + CO 2 (g) -
Un químico quema una muestra de 3.009 g de C 5 H 12 y obtiene 3.774 g de H 2 O. ¿Cuáles son el rendimiento teórico y el rendimiento real?
C 5 H 12 (l) + 8O 2 (g) → 5CO 2 + 6H 2 O (l) -
¿Cuál es el porcentaje de rendimiento en el Ejercicio 3?
-
¿Cuál es el porcentaje de rendimiento en el Ejercicio 4?
-
¿Cuál es el porcentaje de rendimiento en el Ejercicio 5?
- ¿Cuál es el porcentaje de rendimiento en el Ejercicio 6?
RESPUESTAS
- El rendimiento teórico es lo que esperas estequiométricamente de una reacción química; el rendimiento real es lo que realmente obtienes de una reacción química.
-
-
rendimiento teórico = 4.052 g; rendimiento real = 2.675 g
-
-
rendimiento teórico = 0.635 g; rendimiento real = 0.0334 g
-
-
66.02%
-
-
5.26%
5.6: Reactivos limitantes
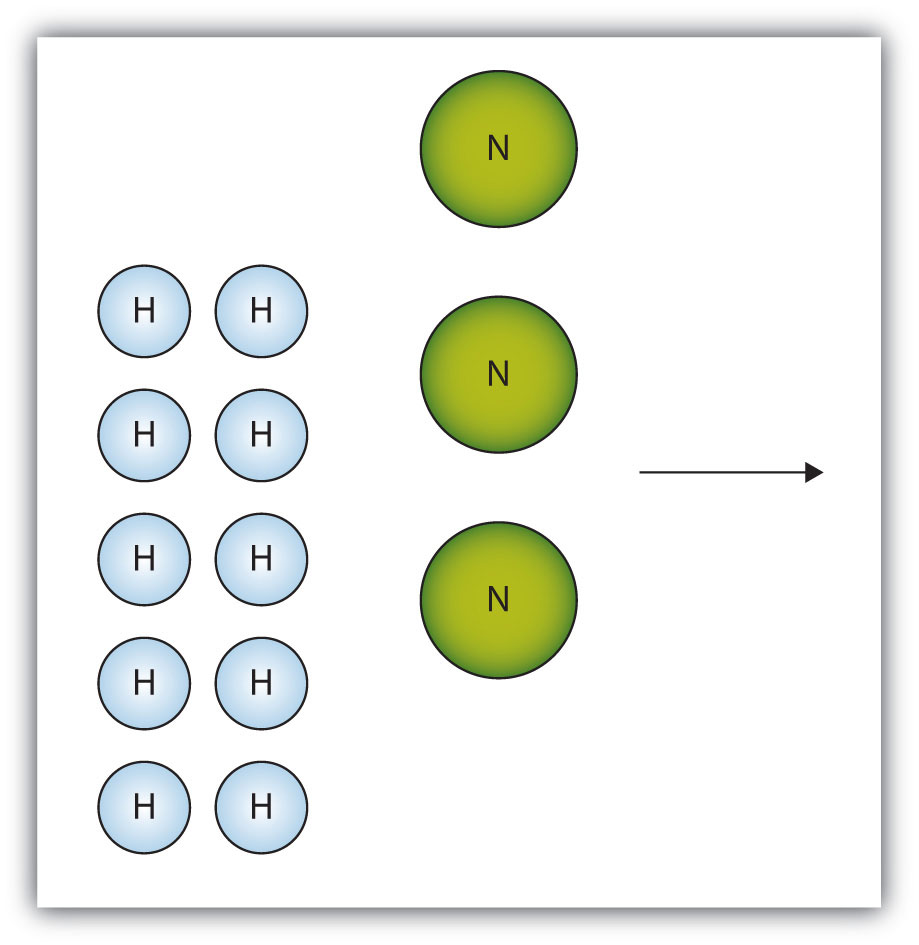
- El cuadro siguiente muestra un grupo de moléculas de nitrógeno e hidrógeno que reaccionarán para producir amoníaco, NH 3. ¿Cuál es el reactivo limitante?
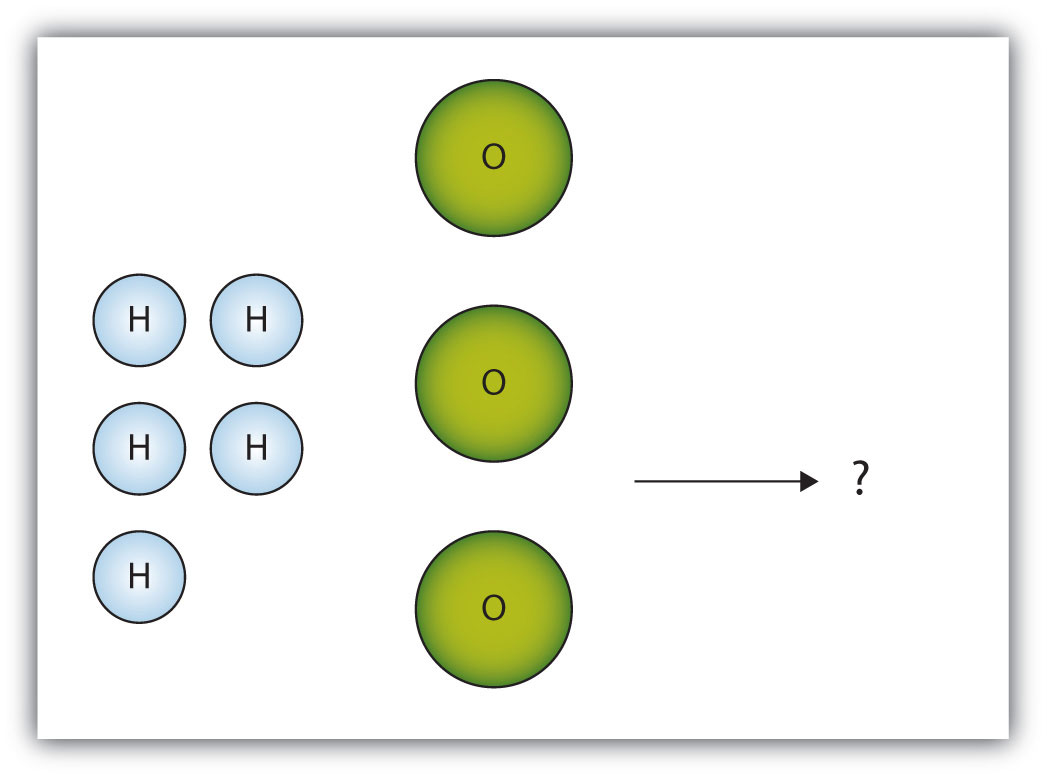
- El cuadro de abajo muestra un grupo de moléculas de hidrógeno y oxígeno que reaccionarán para producir agua, H 2 O. ¿Cuál es el reactivo limitante?
- Ante la afirmación “20.0 g de metano se queman en exceso de oxígeno”, ¿es obvio qué reactivo es el reactivo limitante?
-
Ante la afirmación “el metal se calienta en presencia de exceso de hidrógeno”, ¿es obvio qué sustancia es el reactivo limitante a pesar de no especificar ninguna cantidad de reactivo?
-
El acetileno (C 2 H 2) se forma haciendo reaccionar 7.08 g de C y 4.92 g de H 2.
2C (s) + H 2 (g) → C 2 H 2 (g)¿Cuál es el reactivo limitante? ¿Cuánto del otro reactivo está en exceso?
-
El etano (C 2 H 6) se forma haciendo reaccionar 7.08 g de C y 4.92 g de H 2.
2C (s) + 3H 2 (g) → C 2 H 6 (g)¿Cuál es el reactivo limitante? ¿Cuánto del otro reactivo está en exceso?
- Dadas las cantidades iniciales listadas, ¿cuál es el reactivo limitante y cuánto del otro reactivo está en exceso?
\[\underset{35.6\, g}{P_{4}O_{6}(s)}+6\underset{4.77\, g}{H_{2}O(l)}\rightarrow 4H_{3}PO_{4}\]
- Dadas las cantidades iniciales listadas, ¿cuál es el reactivo limitante y cuánto del otro reactivo está en exceso?
\[\underset{377\, g}{3NO_{2}(g)}+\underset{244\, g}{H_{2}O(l)}\rightarrow 2HNO_{3}(aq)+NO(g)\]
- Para formar el precipitado PbCl 2, se mezclan en solución 2.88 g de NaCl y 7.21 g de Pb (NO 3) 2. ¿Cuánto precipitado se forma? ¿Cuánto de qué reactivo está en exceso?
- En una reacción de neutralización, se hacen reaccionar 18.06 g de KOH con 13.43 g de HNO 3. ¿Qué masa de H 2 O se produce y qué masa de qué reactivo está en exceso?
RESPUESTAS
- El nitrógeno es el reactivo limitante.
-
-
Sí; el metano es el reactivo limitante.
-
-
C es el reactivo limitante; quedan 4.33 g de H 2.
-
-
H 2 O es el reactivo limitante; quedan 25.9 g de P 4 O 6.
-
-
Se forman 6.06 g de PbCl 2; quedan 0.33 g de NaCl.
5.7: Ejercicios adicionales
- ¿Cuántas moléculas de O 2 reaccionarán con 6.022 × 10 23 moléculas de H 2 para hacer agua? La reacción es 2H 2 (g) + O 2 (g) → 2H 2 O (l).
-
¿Cuántas moléculas de H 2 reaccionarán con 6.022 × 10 23 moléculas de N 2 para hacer amoníaco? La reacción es N 2 (g) + 3H 2 (g) → 2NH 3 (g).
-
¿Cuántos moles están presentes en 6.411 kg de CO 2? ¿Cuántas moléculas es esta?
-
¿Cuántos moles están presentes en 2.998 mg de SCl 4? ¿Cuántas moléculas es esta?
-
¿Cuál es la masa en miligramos de 7.22 × 10 20 moléculas de CO 2?
-
¿Cuál es la masa en kilogramos de 3.408 × 10 25 moléculas de SiS 2?
-
¿Cuál es la masa en gramos de 1 molécula de H 2 O?
-
¿Cuál es la masa en gramos de 1 átomo de Al?
-
¿Cuál es el volumen de 3.44 mol de Ga si la densidad de Ga es 6.08 g/mL?
-
¿Cuál es el volumen de 0.662 mol de He si la densidad de Él es de 0.1785 g/L?
-
Para la reacción química
2C 4 H 10 (g) + 13O 2 (g) → 8CO 2 (g) + 10H 2 O (l)asumir que 13.4 g de C 4 H 10 reacciona completamente a los productos. La densidad de CO 2 es de 1.96 g/L ¿Qué volumen en litros de CO 2 se produce?
-
Para la reacción química
2GaCl 3 (s) + 3H 2 (g) → 2Ga (l) + 6HCl (g)si 223 g de GaCl 3 reacciona completamente a los productos y la densidad de Ga es de 6.08 g/mL, ¿qué volumen en mililitros de Ga se produce?
-
Calcular la masa de cada producto cuando 100.0 g de CuCl reaccionan de acuerdo con la reacción
2CuCl (aq) → CuCl 2 (aq) + Cu (s)¿Qué nota de la suma de las masas de los productos? ¿Qué concepto se está ilustrando aquí?
-
Calcular la masa de cada producto cuando 500.0 g de SnCl 2 reaccionan de acuerdo con la reacción
2SnCl 2 (aq) → SnCl 4 (aq) + Sn (s)¿Qué nota de la suma de las masas de los productos? ¿Qué concepto se está ilustrando aquí?
-
¿Qué masa de CO 2 se produce a partir de la combustión de 1 gal de gasolina? La fórmula química de la gasolina puede aproximarse como C 8 H 18. Supongamos que hay 2,801 g de gasolina por galón.
-
¿Qué masa de H 2 O se produce a partir de la combustión de 1 gal de gasolina? La fórmula química de la gasolina puede aproximarse como C 8 H 18. Supongamos que hay 2,801 g de gasolina por galón.
-
Una reacción química tiene un rendimiento teórico de 19.98 g y un rendimiento porcentual de 88.40%. ¿Cuál es el rendimiento real?
-
Una reacción química tiene un rendimiento real de 19.98 g y un rendimiento porcentual de 88.40%. ¿Cuál es el rendimiento teórico?
- Dadas las cantidades iniciales listadas, ¿cuál es el reactivo limitante y qué cantidad de los otros reactivos están en exceso?
\[\underset{35.0\, g}{P_{4}}+\underset{12.7\, g}{3NaOH}+\underset{9.33\, g}{3H_{2}O}\rightarrow 2Na_{2}HPO_{4}+PH_{3}\]
- Dadas las cantidades iniciales listadas, ¿cuál es el reactivo limitante y qué cantidad de los otros reactivos están en exceso?
\[\underset{46.3\, g}{2NaCrO_{2}}+\underset{88.2\, g}{3NaBrO_{4}}+\underset{32.5\, g}{2NaOH}\rightarrow 3NaBrO_{3}+2Na_{2}CrO_{4}+H_{2}O\]
- Verifique que no importa qué producto use para predecir el reactivo limitante usando ambos productos en esta reacción de combustión para determinar el reactivo limitante y la cantidad del reactivo en exceso. Se dan las cantidades iniciales de cada reactivo.
\[\underset{26.3\, g}{C_{3}H_{8}}+\underset{21.8\, g}{5O_{2}}\rightarrow 3CO_{2}(g)+4H_{2}O(l)\]
- Por si acaso sospechas que el Ejercicio 21 está amañado, hazlo para otra reacción química y verifica que no importa qué producto uses para predecir el reactivo limitante usando ambos productos en esta reacción de combustión para determinar el reactivo limitante y la cantidad del reactivo en exceso. Se dan las cantidades iniciales de cada reactivo.
\[\underset{35.0\, g}{2P_{4}}+\underset{12.7\, g}{6NaOH}+\underset{9.33\, g}{6H_{2}O}\rightarrow 3Na_{2}HPO_{4}+5PH_{3}\]
RESPUESTAS
- 1.2044 × 10 24 moléculas
-
-
145.7 mol; 8.77 × 10 25 moléculas
-
-
52.8 mg
-
-
2.99 × 10 −23 g
-
-
39.4 mL
-
-
20.7 L
-
-
67.91 g de CuCl 2; 32.09 g de Cu. Las dos masas suman 100.0 g, la cantidad inicial de material de partida, demostrando la ley de conservación de la materia.
-
-
8,632 g
-
-
17.66 g
-
-
El reactivo limitante es NaOH; quedan 21.9 g de P 4 y 3.61 g de H 2 O.
-
-
Ambos productos predicen que O 2 es el reactivo limitante; quedan 20.3 g de C 3 H 8.