5.7: Reactivos limitantes
- Page ID
- 74840
- Identificar un reactivo limitante de un conjunto de reactivos.
- Calcular la cantidad de producto que se producirá a partir del reactivo limitante.
- Calcular cuánto reactivo (s) queda (n) cuando se completa la reacción.
Además de la suposición de que las reacciones proceden hasta su finalización, una suposición adicional que hemos hecho sobre las reacciones químicas es que todos los reactivos están presentes en las cantidades adecuadas para reaccionar a los productos; este no es siempre el caso. En la Figura\(\PageIndex{2}\) estamos tomando átomos de hidrógeno y átomos de oxígeno (izquierda) para hacer moléculas de agua (derecha). Sin embargo, no hay suficientes átomos de oxígeno para agotar todos los átomos de hidrógeno. Nos quedamos sin átomos de oxígeno y no podemos hacer más moléculas de agua, por lo que el proceso se detiene cuando nos quedamos sin átomos de oxígeno.
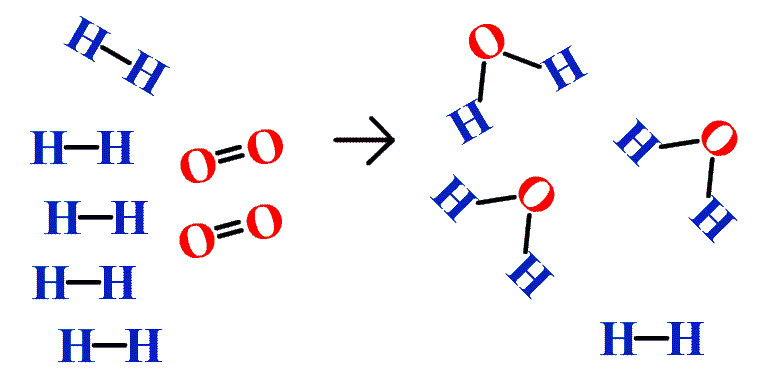
Una situación similar existe para muchas reacciones químicas: normalmente se queda sin un reactivo antes de que todos los otros reaccionantes hayan reaccionado. El reactivo que te quedas sin se llama reactivo limitante; el otro reactivo o reactivos se consideran en exceso. Una habilidad crucial en la evaluación de las condiciones de un proceso químico es determinar qué reactivo es el reactivo limitante y cuál está en exceso.
La clave para reconocer qué reactivo es el reactivo limitante se basa en un cálculo de masa molar o masa-masa: el reactivo que dé la menor cantidad de producto es el reactivo limitante. Lo que tenemos que hacer es determinar una cantidad de un producto (ya sea moles o masa), asumiendo que todos los reactivos reaccionan. Cualquiera que sea el reactivo que proporcione la menor cantidad de ese producto en particular es el reactivo limitante. No importa qué producto usemos, siempre y cuando usemos el mismo cada vez. No importa si determinamos el número de moles o gramos de ese producto; sin embargo, veremos en breve que conocer la masa final del producto puede ser útil.
Por ejemplo, considere esta reacción:
\[4As(s) + 3O_2(g) → 2As_2O_3(s)\nonumber \]
Supongamos que iniciamos una reacción con 50.0 g de As y 50.0 g de O 2. ¿Cuál es el reactivo limitante? Necesitamos realizar dos cálculos de masa molar, cada uno asumiendo que cada reactivo reacciona completamente. Luego comparamos la cantidad del producto producido por cada uno y determinamos cuál es menor.
Los cálculos son los siguientes:
\[50.0\cancel{g\, As}\times \frac{1\cancel{mol\, As}}{74.92\cancel{g\, As}}\times \frac{2\, mol\, As_{2}O_{3}}{4\cancel{mol\, As}}=0.334\, mol\, As_{2}O_{3}\nonumber \]
\[50.0\cancel{g\, O_{2}}\times \frac{1\cancel{mol\, O_{2}}}{32.00\cancel{g\, O_{2}}}\times \frac{2\, mol\, As_{2}O_{3}}{3\cancel{mol\, O_{2}}}=1.04\, mol\, As_{2}O_{3}\nonumber \]
Al comparar estas dos respuestas, es claro que 0.334 mol de As 2 O 3 es menor que 1.04 mol de As 2 O 3, por lo que el arsénico es el reactivo limitante. Si esta reacción se realiza en estas condiciones iniciales, el arsénico se agotará antes de que se acabe el oxígeno. Decimos que el oxígeno está “en exceso”.
Identificar el reactivo limitante, entonces, es sencillo. Sin embargo, generalmente hay dos preguntas asociadas: (1) ¿qué masa de producto (o productos) se forma entonces realmente? y (2) ¿qué masa de qué reactivo queda? La primera pregunta es sencilla de responder: simplemente realizar una conversión del número de moles de producto formados a su masa, utilizando su masa molar. Para As 2 O 3, la masa molar es de 197.84 g/mol; sabiendo que formaremos 0.334 mol de As 2 O 3 bajo las condiciones dadas, obtendremos
\[0.334\cancel{mol\, As_{2}O_{3}}\times \frac{197.84\, g\, As_{2}}{\cancel{1\, mol\, As_{2}O_{3}}}=66.1\, g\, As_{2}O_{3}\nonumber \]
La segunda pregunta es algo más enrevesada de responder. Primero, debemos hacer un cálculo masa-masa relacionando el reactivo limitante (aquí, As) con el otro reactivo (O 2). Una vez que determinamos la masa de O 2 que reaccionó, la restamos de la cantidad original para determinar la cantidad sobrante. Según el cálculo masa-masa,
\[50.0\cancel{g\, As}\times \frac{1\cancel{mol\, As}}{74.92\cancel{g\, As}}\times \frac{3\cancel{mol\, O_{2}}}{4\cancel{mol\, As}}\times \frac{32.00\, g\, O_{2}}{\cancel{1\, mol\, O_{2}}}=16.0\, g\, O_{2}\; reacted\nonumber \]
Debido a que reaccionamos 16.0 g de nuestro O 2 original, restamos eso de la cantidad original, 50.0 g, para obtener la masa de O 2 restante:
50.0 g O 2 − 16.0 g O 2 reaccionado = 34,0 g O 2 sobrante
Debes recordar realizar esta resta final para determinar la cantidad restante; un error común es reportar los 16.0 g como la cantidad restante.
Se combina una cantidad de 5.00 g de Rb con 3.44 g de MgCl 2 de acuerdo con esta reacción química:
\[2R b(s) + MgCl_2(s) → Mg(s) + 2RbCl(s) \nonumber \nonumber \]
¿Qué masa de Mg se forma y qué masa de qué reactivo queda?
Solución
Debido a que la pregunta pregunta qué masa de magnesio se forma, podemos realizar dos cálculos masa-masa y determinar qué cantidad es menor.
\[5.00\cancel{g\, Rb}\times \frac{1\cancel{mol\, Rb}}{85.47\cancel{g\, Rb}}\times \frac{1\cancel{mol\, Mg}}{2\cancel{mol\, Rb}}\times \frac{24.31\, g\, Mg}{\cancel{1\, mol\, Mg}}=0.711\, g\, Mg \nonumber \]
\[3.44\cancel{g\, MgCl_{2}}\times \frac{1\cancel{mol\, MgCl_{2}}}{95.21\cancel{g\, MgCl_{2}}}\times \frac{1\cancel{mol\, Mg}}{1\cancel{mol\, MgCl_{2}}}\times \frac{24.31\, g\, Mg}{\cancel{1\, mol\, Mg}}=0.878\, g\, Mg \nonumber \]
El 0.711 g de Mg es la cantidad menor, por lo que el reactivo asociado —5.00 g de RB— es el reactivo limitante. Para determinar qué cantidad del otro reactivo queda, tenemos que hacer un cálculo masa-masa más para determinar qué masa de MgCl2 reaccionó con los 5.00 g de Rb, y luego restar la cantidad reaccionada de la cantidad original.
\[5.00\cancel{g\, Rb}\times \frac{1\cancel{mol\, Rb}}{85.47\cancel{g\, Rb}}\times \frac{1\cancel{mol\, MgCl_{2}}}{2\cancel{mol\, Rb}}\times \frac{95.21\, g\, Mg}{\cancel{1\, mol\, MgCl_{2}}}=2.78\, g\, MgCl_{2}\: \: reacted \nonumber \]
Porque empezamos con 3.44 g de MgCl2, tenemos
3.44 g MgCl2 − 2.78 g MgCl2 reaccionado = 0.66 g MgCl2 a la izquierda
Dadas las cantidades iniciales listadas, ¿cuál es el reactivo limitante y cuál es la masa del reactivo sobrante?
\[\underbrace{22.7\, g}_{MgO(s)}+\underbrace{17.9\, g}_{H_2S}\rightarrow MgS(s)+H_{2}O(l) \nonumber \]
- Responder
- H 2 S es el reactivo limitante; quedan 1.5 g de MgO.
Resumen
El reactivo limitante es el reactivo que produce la menor cantidad de producto. Los cálculos de masa y masa pueden determinar la cantidad de producto que se produce y la cantidad de los otros reactivos que quedan.


