6.4: Leyes de gas
- Page ID
- 75071
- Conoce lo que se entiende por el término leyes de gas.
- Aprender y aplicar la ley de Boyle.
- Aprender y aplicar la ley de Carlos.
Cuando los científicos del siglo XVII comenzaron a estudiar las propiedades físicas de los gases, notaron algunas relaciones simples entre algunas de las propiedades medibles del gas. Toma presión (P) y volumen (V), por ejemplo. Los científicos señalaron que para una cantidad dada de un gas (generalmente expresado en unidades de moles [n]), si la temperatura (T) del gas se mantenía constante, la presión y el volumen estaban relacionados: A medida que uno aumenta, el otro disminuye. A medida que uno disminuye, el otro aumenta. Decimos que la presión y el volumen están inversamente relacionados.
Sin embargo, hay más: la presión y el volumen de una cantidad dada de gas a temperatura constante están relacionados numéricamente. Si toma el valor de presión y lo multiplica por el valor de volumen, el producto es una constante para una cantidad dada de gas a una temperatura constante:
P × V = constante a las constantes n y T
Si el volumen o la presión cambian mientras la cantidad y la temperatura permanecen iguales, entonces la otra propiedad debe cambiar para que el producto de las dos propiedades siga igual a esa misma constante. Es decir, si las condiciones originales están etiquetadas P 1 y V 1 y las nuevas condiciones están etiquetadas P 2 y V 2, tenemos
P 1 V 1 = constante = P 2 V 2
donde se supone que las propiedades se multiplican juntas. Dejando fuera la parte media, simplemente tenemos
P 1 V 1 = P 2 V 2 a constante n y T
Esta ecuación es un ejemplo de una ley de gas. Una ley de gas es una fórmula matemática simple que permite modelar, o predecir, el comportamiento de un gas. Esta particular ley del gas se llama ley de Boyle, después del científico inglés Robert Boyle, quien la anunció por primera vez en 1662. La figura\(\PageIndex{1}\) muestra dos representaciones de cómo funciona la ley de Boyle.
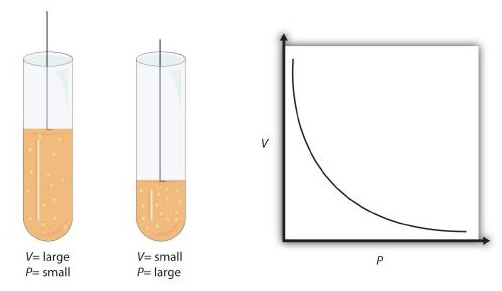
La ley de Boyle es un ejemplo de un segundo tipo de problema matemático que vemos en la química, uno basado en una fórmula matemática. Las tácticas para trabajar con fórmulas matemáticas son diferentes de las tácticas para trabajar con factores de conversión. Primero, la mayoría de las preguntas que tendrás que responder usando fórmulas son preguntas tipo palabra, por lo que el primer paso es identificar qué cantidades se conocen y asignarlas a variables. Segundo, en la mayoría de las fórmulas, se deben realizar algunos reordenamientos matemáticos (es decir, álgebra) para resolver una variable desconocida. La regla es que para encontrar el valor de la variable desconocida, se debe aislar matemáticamente la variable desconocida por sí misma y en el numerador de un lado de la ecuación. Por último, las unidades deben ser consistentes. Por ejemplo, en la ley de Boyle hay dos variables de presión; deben tener la misma unidad. También hay dos variables de volumen; también deben tener la misma unidad. En la mayoría de los casos, no importará cuál sea la unidad, pero la unidad debe ser la misma en ambos lados de la ecuación.
Una muestra de gas tiene una presión inicial de 2.44 atm y un volumen inicial de 4.01 L. Su presión cambia a 1.93 atm. ¿Cuál es el nuevo volumen si la temperatura y la cantidad se mantienen constantes?
Solución
Primero, determinar qué cantidades nos dan. Se nos da una presión inicial y un volumen inicial, así que dejemos que estos valores sean P 1 y V 1:
P 1 = 2.44 atm y V 1 = 4.01 L
Se nos da otra cantidad, presión final de 1.93 atm, pero no un volumen final. Este volumen final es la variable para la que resolveremos.
P 2 = 1.93 atm y V 2 =? L
Sustituyendo estos valores en la ley de Boyle, obtenemos
(2.44 atm) (4.01 L) = (1.93 atm) V 2
Para resolver la variable desconocida, la aislamos dividiendo ambos lados de la ecuación por 1.93 atm, tanto el número como la unidad:
\[\frac{(2.44\, atm)(4.01\, L)}{1.93\, atm}=\frac{(1.93\, atm)\, V_{2}}{1.93\, atm}\nonumber \]
Obsérvese que, en el lado izquierdo de la ecuación, la unidad atm está en el numerador y el denominador de la fracción. Cancelan algebraicamente, tal como lo haría un número. En el lado derecho, la unidad atm y el número 1.93 están en el numerador y el denominador, por lo que toda la cantidad cancela:
\[\frac{(2.44\, \cancel{atm})(4.01\, L)}{1.93\, \cancel{atm}}=\frac{(1.93\, \cancel{atm})\, V_{2}}{1.93\, \cancel{atm}}\nonumber \]
Lo que nos queda es
\[\frac{(2.44)(4.01\, L)}{1.93}=V_{2}\nonumber \]
Ahora simplemente multiplicamos y dividimos los números entre sí y combinamos la respuesta con la\(L\) unidad, que es una unidad de volumen. Al hacerlo, obtenemos\(V_2 = 5.07\, L\)
¿Tiene sentido esta respuesta? Sabemos que la presión y el volumen están inversamente relacionados; a medida que uno disminuye, el otro aumenta. La presión está disminuyendo (de 2.44 atm a 1.93 atm), por lo que el volumen debe estar aumentando para compensar, y es (de 4.01 L a 5.07 L). Entonces la respuesta tiene sentido basada en la ley de Boyle.
Si P 1 = 334 torr, V 1 = 37.8 mL, y P 2 = 102 torr, ¿qué es V 2?
- Responder
-
124 mL
Como se mencionó, puede usar cualquier unidad para presión o volumen, pero ambas presiones deben expresarse en las mismas unidades, y ambos volúmenes deben expresarse en las mismas unidades.
Una muestra de gas tiene una presión inicial de 722 torr y un volumen inicial de 88.8 mL. Su volumen cambia a 0.663 L. ¿Cuál es la nueva presión?
Solución
Todavía podemos usar la ley de Boyle para responder a esto, pero ahora las dos cantidades volumétricas tienen diferentes unidades. No importa qué unidad cambiemos, siempre y cuando realicemos la conversión correctamente. Cambiemos los 0.663 L a mililitros:
\[0.663\, L\times \frac{1000\, ml}{1\, L}=663\, ml\nonumber \]
Ahora que ambas cantidades en volumen tienen las mismas unidades, podemos sustituirlas en la ley de Boyle:
\[(722\, torr)(88.8\, ml)=P_{2}(663\, ml)\nonumber \]
\[\frac{(722\, torr)(88.8)\, ml}{(663\, ml)}=P_{2}\nonumber \]
Las unidades mL cancelan, y multiplicamos y dividimos los números para obtener P 2 = 96.7 torr
El volumen va en aumento, y la presión va disminuyendo, que es como se esperaba para la ley de Boyle.
Si V 1 = 456 mL, P 1 = 308 torr y P 2 = 1.55 atm, ¿qué es V 2?
- Responder
-
119 mL
Hay otras características medibles de un gas. Uno de ellos es la temperatura (T). Quizás se pueda variar la temperatura de una muestra de gas y señalar qué efecto tiene sobre las otras propiedades del gas. Los primeros científicos hicieron precisamente esto, descubriendo que si la cantidad de un gas y su presión se mantienen constantes, entonces cambiar la temperatura cambia el volumen (V). A medida que aumenta la temperatura, aumenta el volumen; a medida que la temperatura disminuye, el volumen Decimos que estas dos características están directamente relacionadas.
Una relación matemática entre V y T debería ser posible excepto por un pensamiento: ¿qué escala de temperatura debemos usar? Sabemos por el Capítulo 2 que la ciencia utiliza varias escalas de temperatura posibles. Los experimentos muestran que el volumen de un gas está relacionado con su temperatura absoluta en Kelvin, no su temperatura en grados Celsius. Si la temperatura de un gas se expresa en kelvin, entonces los experimentos muestran que la relación de volumen a temperatura es una constante:
\[\frac{V}{T}=constant\nonumber \]
Podemos modificar esta ecuación como modificamos la ley de Boyle: las condiciones iniciales V 1 y T1 tienen cierto valor, y el valor debe ser el mismo cuando las condiciones del gas se cambian a algunas condiciones nuevas V 2 y T 2, siempre y cuando la presión y la cantidad de gas permanezcan constantes. Así, tenemos otra ley de gas:
\[\frac{V_{1}}{T_{1}}=\frac{V_{2}}{T_{2}}\; at\; constant\; P\; and\; n\nonumber \]
Esta ley del gas se conoce comúnmente como la ley de Carlos, después del científico francés Jacques Charles, quien realizó experimentos con gases en la década de 1780. Las tácticas para usar esta fórmula matemática son similares a las de la ley de Boyle. Para determinar una cantidad desconocida, utilice álgebra para aislar la variable desconocida por sí misma y en el numerador; las unidades de variables similares deben ser las mismas. Pero agregamos una táctica más: todas las temperaturas deben expresarse en la escala de temperatura absoluta (Kelvin). Como recordatorio, revisamos la conversión entre la escala de temperatura absoluta y la escala de temperatura Celsius:
K = °C + 273
donde K representa la temperatura en kelvin, y °C representa la temperatura en grados Celsius.
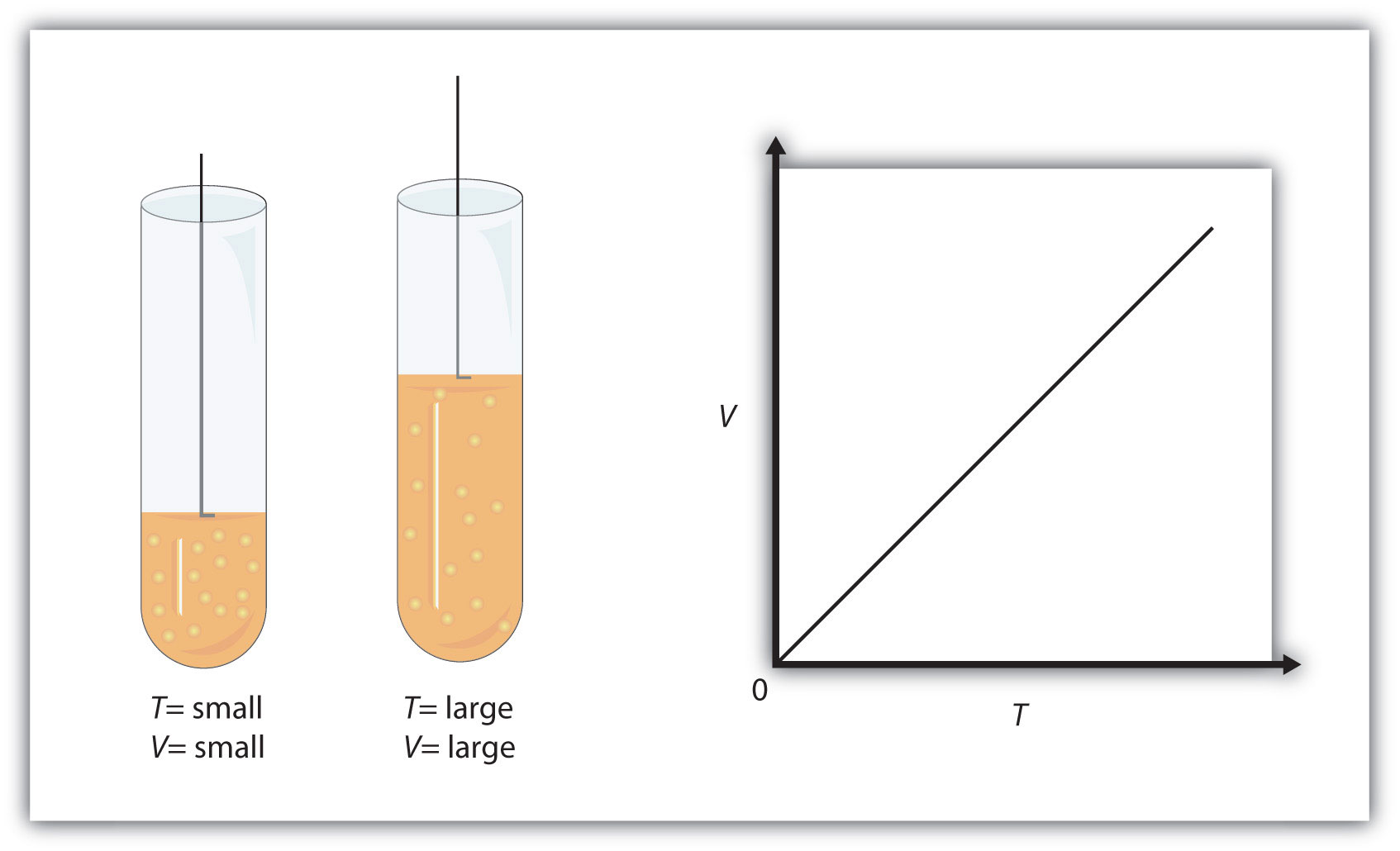
Una muestra de gas tiene un volumen inicial de 34.8 mL y una temperatura inicial de 315 K. ¿Cuál es el nuevo volumen si la temperatura se incrementa a 559 K? Asumir presión y cantidad constantes para el gas.
Solución
Primero, asignamos los valores dados a sus variables. El volumen inicial es V 1, por lo que V 1 = 34.8 mL, y la temperatura inicial es T 1, por lo que T 1 = 315 K. La temperatura se incrementa a 559 K, por lo que la temperatura final T 2 = 559 K. Observamos que las temperaturas ya están dadas en kelvin, por lo que no necesitamos convertir las temperaturas. Sustituir en la expresión los rendimientos de la ley de Charles
\[\frac{34.8\, ml}{315\, K}=\frac{V_{2}}{559\, K}\nonumber \]
Resolvemos para V 2 aislando algebraicamente la variable V 2 en un lado de la ecuación. Esto lo hacemos multiplicando ambos lados de la ecuación por 559 K (número y unidad). Cuando hacemos esto, la unidad de temperatura cancela en el lado izquierdo, mientras que todo el 559 K cancela en el lado derecho:
\[\frac{(559\cancel{K})(34.8\, ml)}{315\, \cancel{K}}=\frac{V_{2}(\cancel{559\, K})}{\cancel{559\, K}}\nonumber \]
La expresión simplifica a
\[\frac{(559)(34.8\, ml)}{315}=V_{2}\nonumber \]
Al multiplicar y dividir los números, vemos que la única unidad restante es mL, por lo que nuestra respuesta final es
V 2 = 61.8 mL
¿Tiene sentido esta respuesta? Sabemos que a medida que aumenta la temperatura, aumenta el volumen. Aquí, la temperatura está aumentando de 315 K a 559 K, por lo que el volumen también debería aumentar, lo que hace.
Si V 1 = 3.77 L y T 1 = 255 K, ¿qué es V 2 si T 2 = 123 K?
Responder
1.82 L
Es más complicado matemáticamente si se debe calcular una temperatura final porque la variable T está en el denominador de la ley de Carlos. Hay varias formas matemáticas de trabajar esto, pero quizás la forma más sencilla es tomar el recíproco de la ley de Carlos. Es decir, en lugar de escribirlo como
\[\frac{V_{1}}{T_{1}}=\frac{V_{2}}{T_{2}}\nonumber \]
escribir la ecuación como
\[\frac{T_{1}}{V_{1}}=\frac{T_{2}}{V_{2}}\nonumber \]
Sigue siendo una igualdad y una forma correcta de la ley de Carlos, pero ahora la variable de temperatura está en el numerador, y el álgebra requerida para predecir una temperatura final es más simple.
Una muestra de un gas tiene un volumen inicial de 34.8 L y una temperatura inicial de −67°C. ¿Cuál debe ser la temperatura del gas para que su volumen sea 25.0 L?
Solución
Aquí, estamos buscando una temperatura final, por lo que usaremos la forma recíproca de la ley de Carlos. Sin embargo, la temperatura inicial se da en grados Celsius, no en kelvin. Debemos convertir la temperatura inicial a kelvin:
−67 °C + 273 = 206 K
Al usar la ley de gases, debemos usar T 1 = 206 K como temperatura. Sustituyendo a la forma recíproca de la ley de Carlos, obtenemos
\[\frac{206\, K}{34.8\, L}=\frac{T_{2}}{25.0\, L}\nonumber \]
Llevando la cantidad de 25.0 L al otro lado de la ecuación, obtenemos
\[\frac{(25.0\cancel{L})(206\, K)}{34.8\cancel{L}}=T_{2}\nonumber \]
Las unidades L cancelan, por lo que nuestra respuesta final es T 2 = 148 K
Esto también es igual a −125°C. A medida que disminuye la temperatura, el volumen disminuye, lo que hace en este ejemplo.
Si V 1 = 623 mL, T 1 = 255°C, y V 2 = 277 mL, ¿qué es T 2?
- Responder
-
235 K, o −38 °C
Resumen
- El comportamiento de los gases se puede modelar con leyes de gas.
- La ley de Boyle relaciona la presión y el volumen de un gas a temperatura y cantidad constantes.
- La ley de Charles relaciona el volumen y la temperatura de un gas a presión y cantidad constantes.
- En las leyes de gas, las temperaturas siempre deben expresarse en kelvin.


