14.E: Reacción de Oxidación-Reducción (Ejercicios)
- Page ID
- 74745
14.2: Reacciones de Oxidación-Reducción
- ¿Es esta reacción una reacción redox? Explique su respuesta. 2K (s) + Br 2 (l) → 2KBr (s)
- ¿Es esta reacción una reacción redox? Explique su respuesta. 2NaCl (ac) + Pb (NO 3) 2 (aq) → 2nANO 3 (aq) + PbCl 2 (s)
- ¿Qué sustancia pierde electrones y qué sustancia gana electrones en esta reacción? 2Mg (s) + O 2 (g) → 2MgO
- ¿Qué sustancia pierde electrones y qué sustancia gana electrones en esta reacción? 16Fe (s) + 3S 8 (s) → 8Fe 2 S 3 (s)
- ¿Qué sustancia se oxida y qué sustancia se reduce en esta reacción? 2Li (s) + O 2 (g) → Li 2 O 2 (s)
- ¿Qué sustancia se oxida y qué sustancia se reduce en esta reacción? 2Fe (s) + 3I 2 (s) → 2FeI 3 (s)
- ¿Cuáles son dos definiciones diferentes de oxidación?
- ¿Cuáles son dos definiciones diferentes de reducción?
- Asignar números de oxidación a los átomos en cada sustancia.
- P 4
- SO 3
- SO 3 2 −
- Ca 3 (PO 3) 2
- Asignar números de oxidación a los átomos en cada sustancia.
- PCl 5
- (NH 4) 2 Se
- Ag
- Li 2 O 2
- Asignar números de oxidación a los átomos en cada sustancia.
- NO
- NO 2
- CrCl 2
- CrCl 3
- Asignar números de oxidación a los átomos en cada sustancia.
- Nah
- N 2 O 3
- NO 2 −
- CUno 3
- Asignar números de oxidación a los átomos en cada sustancia.
- CH 2 O
- NH 3
- Rb 2 SO 4
- Zn (C 2 H 3 O 2) 2
- Asignar números de oxidación a los átomos en cada sustancia.
- C 6 H 6
- B (OH) 3
- Li 2 S
- Au
- Identificar lo que se está oxidando y reduciendo en esta reacción redox asignando números de oxidación a los átomos. 2NO + Cl 2 → 2NOCl
- Identificar lo que se está oxidando y reduciendo en esta reacción redox asignando números de oxidación a los átomos. Sr + SO 3 → SrSO 3
- Identificar lo que se está oxidando y reduciendo en esta reacción redox asignando números de oxidación a los átomos. 2kRf 2 + 2H 2 O → 2Kr + 4HF + O 2
- Identificar lo que se está oxidando y reduciendo en esta reacción redox asignando números de oxidación a los átomos. SO 3 + SCl 2 → SocL 2 + SO 2
- Identificar lo que se está oxidando y reduciendo en esta reacción redox asignando números de oxidación a los átomos. 2Rb + MgCl 2 → 2RbCl + Mg
- Identificar lo que se está oxidando y reduciendo en esta reacción redox asignando números de oxidación a los átomos. 2C 8 H 18 + 25O 2 → 16CO 2 + 18H 2 O
RESPUESTAS
- sí porque los números de oxidación están cambiando
-
perder: Mg; ganancia: O
-
oxidado: Li; reducido: O
- aumento en el número de oxidación; pérdida de electrones
-
- P: 0
- S: +6; O: −2
- S: +4; O: −2
- Ca: +2; P: +3; O: −2
-
- N: +2; O: −2
- N: +4; O: −2
- Cr: +2; Cl: −1
- Cr: +3; Cl: −1
-
- C: 0; H: +1; O: −2
- N: −3; H: +1
- Rb: +1; S: +6; O: −2
- Zn: +2; C: 0; H: +1; O: −2
- oxidado: N; reducido: Cl
- oxidado: O; reducido: Kr
- oxidado: Rb; reducido: Mg
14.3: Equilibrar las reacciones redox
- Equilibrar estas reacciones redox mediante inspección.
- Na + F 2 → NaF
- Al 2 O 3 + H 2 → Al + H 2 O
- Equilibrar estas reacciones redox mediante inspección.
- Fe 2 S 3 + O 2 → Fe 2 O 3 + S
- Cu 2 O + H 2 → Cu + H 2 O
- Equilibrar estas reacciones redox mediante inspección.
- CH 4 + O 2 → CO 2 + H 2 O
- P 2 O 5 + Cl 2 → PCl 3 + O 2
- Equilibrar estas reacciones redox mediante inspección.
- PbCl 2 + FeCl 3 → PbCl 4 + FeCl 2
- SO 2 + F 2 → SF 4 + DE 2
- Equilibrar estas reacciones redox mediante el método de media reacción.
- Ca + H + → Ca 2 + H 2
- Sn 2 + → Sn + Sn 4 + (Pista: ambas medias reacciones comenzarán con el mismo reactivo.)
- Equilibrar estas reacciones redox mediante el método de media reacción.
- Fe 3 + + Sn 2 + → Fe + Sn 4 +
- Pb 2 + → Pb + Pb 4 + (Pista: ambas medias reacciones comenzarán con el mismo reactivo.)
- Equilibrar estas reacciones redox mediante el método de media reacción.
- Na + Hg 2 Cl 2 → NaCl + Hg
- Al 2 O 3 + C → Al + CO 2
- Equilibrar estas reacciones redox mediante el método de media reacción.
- Br − + I 2 → I − + Br 2
- CrCl 3 + F 2 → CrF 3 + Cl 2
- Equilibrar estas reacciones redox que ocurren en solución acuosa. Utilizar cualquier especie derivada del agua que sea necesaria; puede haber más de una ecuación equilibrada correcta.
- Cu + NO 3 − → Cu 2 + + NO 2
- Fe + MnO 4 − → Fe 3 + + Mn
- Equilibrar estas reacciones redox que ocurren en solución acuosa. Utilizar cualquier especie derivada del agua que sea necesaria; puede haber más de una ecuación equilibrada correcta.
- CrO 3 + Ni 2 + → Cr 3 + Ni 3 +
- Oso 4 + C 2 H 4 → Os + CO 2
- Equilibrar estas reacciones redox que ocurren en solución acuosa. Utilizar cualquier especie derivada del agua que sea necesaria; puede haber más de una ecuación equilibrada correcta.
- ClO − + Ti 2 + → Ti 4 + Cl −
- BrO 3 − + Ag → Ag + + BrO 2
- Equilibrar estas reacciones redox que ocurren en solución acuosa. Utilizar cualquier especie derivada del agua que sea necesaria; puede haber más de una ecuación equilibrada correcta.
- H 2 O 2 + NO → N 2 O 3 + H 2 O
- VO 2 + + NO → V 3+ + NO 2
- Explique por qué esta ecuación química no está balanceada y equilibrela si se puede equilibrar: Cr 2 + Cl 2 → Cr 3 + + 2Cl −
- Explique por qué esta ecuación no está balanceada y equilibrela si se puede equilibrar: O 2 + 2H 2 O + Br 2 → 4OH − + 2Br −
RESPUESTAS
-
- 2Na + F 2 → 2NaF
- Al 2 O 3 + 3H 2 → 2Al + 3H 2 O
-
- CH 4 + 2O 2 → CO 2 + 2H 2 O
- 2P 2 O 5 + 6Cl 2 → 4pcL 3 + 5O 2
-
- Ca + 2H + → Ca 2 + H 2
- 2Sn 2 + → Sn + Sn 4 +
-
- 2Na + Hg 2 Cl 2 → 2NaCl + 2Hg
- 2Al 2 O 3 + 3C → 4Al + 3CO 2
-
- 4H + + Cu + 2NO 3 − → Cu 2 + + 2NO 2 + 2H 2 O en solución ácida; 2H 2 O + Cu + 2NO 3 − → Cu 2 + + 2NO 2 + 4OH − en solución básica
- 24H + 3MnO 4 − + 7Fe → 7Fe 3 + + 3Mn + 12H 2 O en solución ácida; 12H 2 O + 3MnO 4 − + 7Fe → 7Fe 3 + + 3Mn + 24OH − en solución básica
-
- 2H + ClO − + Ti 2 + → Cl − + H 2 O + Ti 4 + en solución ácida; H 2 O + ClO − + Ti 2 + → Cl − + Ti 4 + + 2OH − en solución básica
- 2H + + Bro 3 − + Ag → Bro 2 + H 2 O + Ag + en solución ácida; H 2 O + BRo 3 − + Ag → BrO 2 + Ag + + 2OH − en solución básica
- Los cargos no están debidamente equilibrados. La ecuación equilibrada correcta es 2Cr 2 + + Cl 2 → 2Cr 3 + + 2Cl −.
14.4: Aplicaciones de Reacciones Redox - Celdas Voltáicas
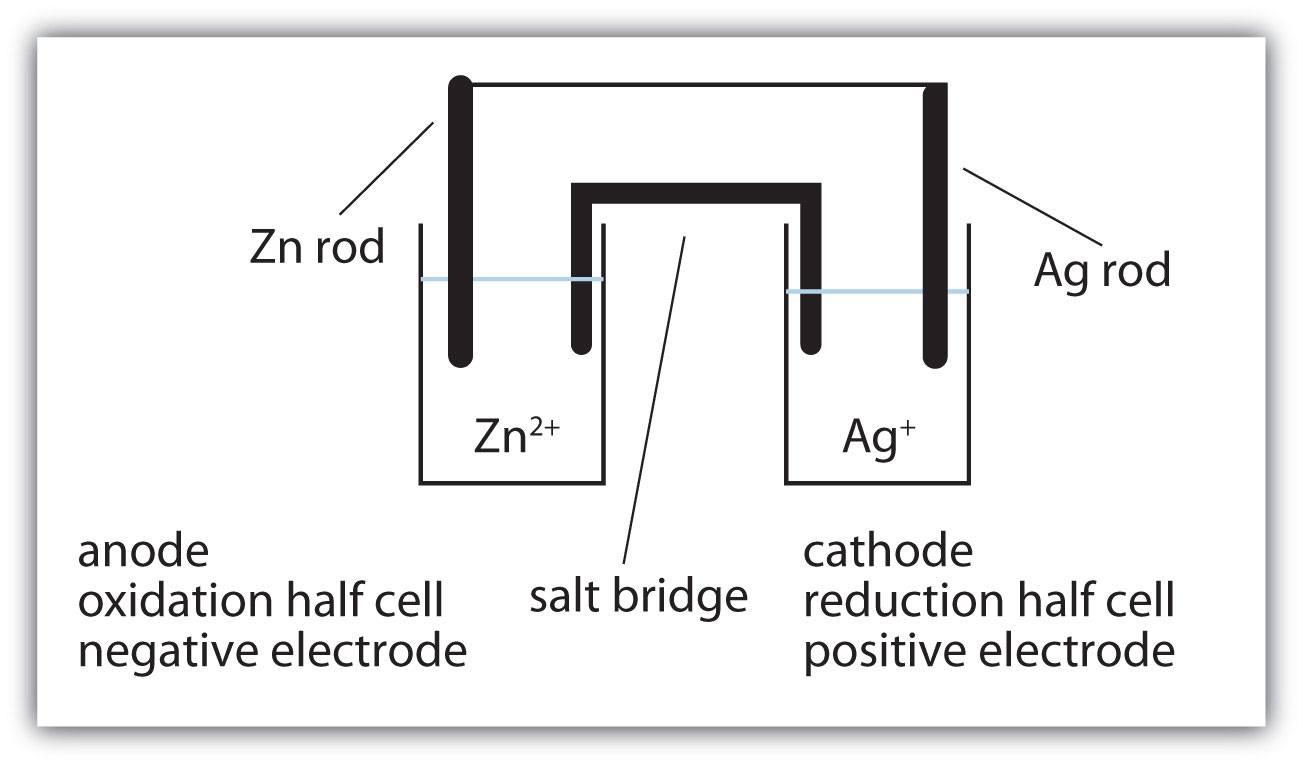
- Dibujar la celda voltaica representada por esta reacción y etiquetar el cátodo, el ánodo, el puente de sal, la media celda de oxidación, la media celda de reducción, el electrodo positivo y el electrodo negativo. Utilice la Fig. 14.4.1 como guía. Zn + 2Ag + → Zn 2 + + 2Ag
- Dibujar la celda voltaica representada por esta reacción y etiquetar el cátodo, el ánodo, el puente de sal, la media celda de oxidación, la media celda de reducción, el electrodo positivo y el electrodo negativo. Utilice la Fig. 14.4.1 como guía. 3Mg + 2Cr 3 + → 3Mg 2 + + 2Cr
- ¿Cuál es el voltaje de esta media reacción? 2F − → F 2 + 2e −
- ¿Cuál es el voltaje de esta media reacción? Na → Na + + e −
- ¿Cuál es el voltaje de la célula voltaica en el Ejercicio 1? Consultar Tabla 14.4.1.
- ¿Cuál es el voltaje de la célula voltaica en el Ejercicio 2? Consultar Tabla 14.4.1.
- Equilibrar esta reacción redox y determinar su voltaje. ¿Es espontáneo? Li + + Al → Li + Al 3 +
- Equilibrar esta reacción redox y determinar su voltaje. ¿Es espontáneo? Pb 2 + + Ni → Pb + Ni 2 +
- Equilibrar esta reacción redox y determinar su voltaje. ¿Es espontáneo? Cu 2 + + Ag + Cl − → Cu + AgCl
- Equilibrar esta reacción redox y determinar su voltaje. ¿Es espontáneo? Mn 2 + + Br 2 → MnO 4 − + Br −
- ¿Qué reacción representa la reacción catódica en el Ejercicio 7? ¿La reacción del ánodo?
- ¿Qué reacción representa la reacción catódica en el Ejercicio 8? ¿La reacción del ánodo?
- ¿Qué reacción representa la reacción catódica en el Ejercicio 9? ¿La reacción del ánodo?
- ¿Qué reacción representa la reacción catódica en el Ejercicio 10? ¿La reacción del ánodo?
- Una celda voltaica se basa en esta reacción: Ni + 2Au + → Ni 2 + + 2Au; Si el voltaje de la celda es de 0.33 V, cuál es el potencial de reducción estándar del Au + + e − → ¿La mitad de reacción de Au?
- Una celda voltaica se basa en esta reacción: 3Pb + 2V 3 + → 3Pb 2 + 2V; Si el voltaje de la celda es −0.72 V, cuál es el potencial de reducción estándar del V 3+ + 3e − → V ¿media reacción?
- ¿Qué especies se oxidan y qué especies se están reduciendo en una célula seca?
- ¿Qué especies se oxidan y qué especies se están reduciendo en una pila alcalina?
- ¿Qué especies se oxidan y qué especies se están reduciendo en una batería de botón de óxido de plata?
- ¿Qué especies se oxidan y qué especies se están reduciendo en una batería de almacenamiento de plomo?
- Con base en los datos de la Tabla 14.4.1, ¿cuál es la batería de mayor voltaje que puede construir?
- Con base en los datos de la Tabla 14.4.1, ¿cuál es la batería de menor voltaje que puede construir? (Esto puede ser más difícil de responder que el Ejercicio 21.)
RESPUESTAS
- −2.87 V
-
1.56 V
-
3Li + + Al → 3Li + Al 3 +; −1.39 V; no espontáneo
-
Cu 2 + + 2Ag + 2Cl − → Cu + 2AgCl; 0.12 V; espontáneo
-
reacción catódica: Li + + e − → Li; reacción anódica: Al → Al 3 + + 3e −
-
reacción catódica: Cu 2 + + 2e − → Cu; reacción anódica: Ag + Cl − → AgCl + e −
-
0.08 V
-
oxidado: Zn; reducido: Mn
-
oxidado: Zn; reducido: Ag
-
5.92 V de la reacción de F 2 y Li
14.5: Electrólisis
- Definir celda electrolítica.
- ¿En qué se diferencia el funcionamiento de una celda electrolítica de una celda voltaica?
- Enumere al menos tres elementos que se producen por electrólisis.
- Escribir las medias reacciones para la electrólisis de los elementos enumerados en el Ejercicio 3.
- Con base en la Tabla 14.4.1, ¿qué voltaje se debe aplicar a una celda electrolítica para electrochapar cobre a partir de Cu 2 +?
- Con base en la Tabla 14.4.1, ¿qué voltaje se debe aplicar a una celda electrolítica para electrochapar aluminio a partir de Al 3 +?
RESPUESTAS
- una celda electroquímica en la que se fuerza la carga y se produce una reacción no espontánea
-
cualquiera de los tres siguientes: Al, K, Li, Na, Cl 2 o Mg
-
0.34 V
Ejercicios adicionales
- La oxidación se definió una vez como la adición química de oxígeno a una sustancia. Utilice esta reacción para argumentar que esta definición es consistente con la definición moderna de oxidación: 2Mg + O 2 → 2MgO
- La reducción se definió una vez como la adición química de hidrógeno a una sustancia. Utilice esta reacción para argumentar que esta definición es consistente con la definición moderna de reducción: C 2 H 2 + 2H 2 → C 2 H 6
- Asignar números de oxidación a los átomos en cada sustancia.
- Kr (criptón)
- tetrafluoruro de kriptón (KrF 4)
- difluoruro de dioxígeno (O 2 F 2)
- Asignar números de oxidación a los átomos en cada sustancia.
- hidruro de litio (LiH)
- peróxido de potasio (K 2 O 2)
- fluoruro de potasio (KF)
- Los átomos de N pueden tener una amplia gama de números de oxidación. Asignar números de oxidación para el átomo de N en cada compuesto, todos los cuales son compuestos conocidos.
- N 2 O 5
- N 2 O 4
- NO 2
- NO
- N 2 H 4
- NH 3
- Los átomos de Cr pueden tener una amplia gama de números de oxidación. Asignar números de oxidación para el átomo de Cr en cada compuesto, todos los cuales son compuestos conocidos.
- Na 2 CrO 4
- Na 2 Cr 2 O 7
- CrF 5
- CrCl 3
- CrCl 2
- Equilibrar esta reacción redox por inspección: S 8 + O 2 → SO 2
- Equilibrar esta reacción redox por inspección: C 18 H 38 + O 2 → CO 2 + H 2 O
- Equilibrar esta reacción redox por el método de media reacción asumiendo una solución ácida: Cr 2 O 7 2 − + Fe → Cr 3 + Fe 3 +
- Equilibrar la reacción redox en el Ejercicio 9 mediante el método de media reacción asumiendo una solución básica.
- El ion uranilo (UO 2 2 +) es un ion bastante estable de uranio que requiere reductores fuertes para reducir aún más el número de oxidación del uranio. Equilibrar esta reacción redox usando el método de media reacción asumiendo una solución ácida. UO 2 2+ + HN 3 → U + N 2
- Equilibrar la reacción redox en el Ejercicio 11 mediante el método de media reacción asumiendo una solución básica.
- El zinc metálico se puede disolver por ácido, que contiene iones H +. Demostrar que esto es consistente con el hecho de que esta reacción tiene un voltaje espontáneo: Zn + 2H + → Zn 2 + H 2
- El cobre metálico no puede ser disuelto por el ácido, que contiene iones H +. Demostrar que esto es consistente con el hecho de que esta reacción tiene un voltaje no espontáneo: Cu + 2H + → Cu 2 + H 2
- Una reacción de desproporción ocurre cuando un solo reactivo es oxidado y reducido. Equilibrar y determinar el voltaje de esta reacción de desproporción. Usar los datos de la Tabla 14.4.1 - Potenciales de Reducción Estándar de Medias Reacciones: Cr 2 + → Cr + Cr 3 +
- Una reacción de desproporción ocurre cuando un solo reactivo es oxidado y reducido. Equilibrar y determinar el voltaje de esta reacción de desproporción. Usar los datos de la Tabla 14.4.1 - Potenciales de Reducción Estándar de Medias Reacciones: Fe 2 + → Fe + Fe 3 +
- ¿Cuál sería la reacción general de una pila de combustible que utiliza CH 4 como combustible?
- ¿Cuál sería la reacción general para una pila de combustible que utiliza gasolina (fórmula general C 8 H 18) como combustible?
- Cuando el NaCl se somete a electrólisis, el sodio aparece en el cátodo. ¿La definición de cátodo es la misma para una celda electrolítica que para una celda voltaica?
- Cuando el NaCl se somete a electrólisis, el cloro aparece en el ánodo. ¿La definición de ánodo es la misma para una celda electrolítica que para una celda voltaica?
- Un premio se está chapando con oro puro antes de ser entregado a un destinatario. Si el área del premio es de 55.0 cm 2 y será chapada con 3.00 µm de Au, ¿qué masa de Au se chapará en el premio? La densidad de Au es de 19.3 g/cm 3.
- La unidad de carga eléctrica se llama culombios (C). Se necesitan 96.500 culombios de carga para reducir 27.0 g de Al de Al 3 + a Al metal. A los 1,040 cm 3, ¿cuántos culombios de carga se necesitaron para reducir el aluminio en la tapa del monumento a Washington, asumiendo que la tapa es pura Al? La densidad de Al es de 2.70 g/cm 3.
Contestar
A medida que se agrega oxígeno al magnesio, se está oxidando. En términos modernos, los átomos de Mg están perdiendo electrones y siendo oxidados, mientras que los electrones van a los átomos de O.
- Kr: 0
- Kr: +4; F: −1
- O: +1; F: −1
- +5
- +4
- +4
- +2
- −2
- −3
S 8 + 8O 2 → 8SO 214H + + Cr 2 O 7 2 − + 2Fe → 2Cr 3 + + 7H 2 O + 2Fe 3 +
6HN 3 + UO 2 2 + → U + 2H 2 O + 9N 2 + 2H +
El voltaje de la reacción es +0.76 V, lo que implica una reacción espontánea.
3Cr 2 + → Cr + 2Cr 3 +; −0.50 V
CH 4 + 2O 2 → CO 2 + 2H 2 O
sí porque la reducción ocurre en el cátodo
0.318 g