14.5: Electrólisis
- Page ID
- 74759
- Describir la electrólisis desde una perspectiva de reacciones redox.
- Dar ejemplos de aplicaciones de electrólisis.
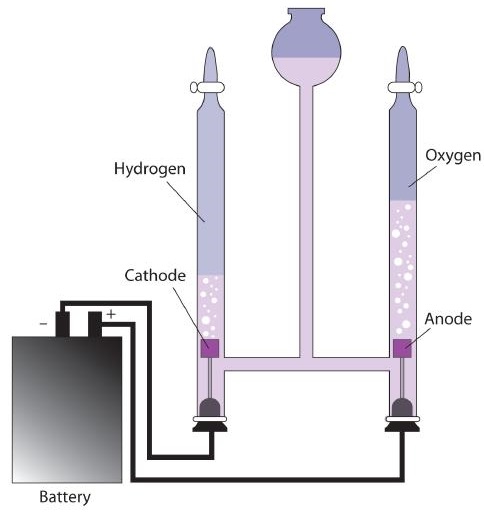
Hasta este punto, hemos considerado reacciones redox para procesos que son espontáneos. Cuando se configura como una célula voltaica o batería, tales reacciones pueden ser utilizadas como fuente de electricidad. No obstante, es posible ir en la otra dirección. Al forzar la electricidad a una celda, podemos hacer que ocurra una reacción redox que normalmente no sería espontánea. En estas circunstancias, la celda se llama celda electrolítica, y el proceso que ocurre en la celda se llama electrólisis (Figura\(\PageIndex{1}\)).
La electrólisis tiene muchas aplicaciones. Por ejemplo, si el NaCl se funde a aproximadamente 800°C en una celda electrolítica y se pasa una corriente eléctrica a través de ella, el sodio elemental aparecerá en el cátodo y el cloro elemental aparecerá en el ánodo a medida que ocurren las dos reacciones siguientes:
\[Na^+ + e^− \rightarrow Na\nonumber \]
\[2 Cl^− → Cl_2 + 2e^−\nonumber \]
Normalmente esperamos que el sodio elemental y el cloro reaccionen espontáneamente para hacer NaCl. Sin embargo, al usar una entrada de electricidad, podemos forzar que ocurra la reacción opuesta y generar los elementos. El litio, el potasio y el magnesio también se pueden aislar de los compuestos por electrólisis.
Otro elemento que se aísla por electrólisis es el aluminio. El aluminio antiguamente era un metal difícil de aislar en su forma elemental; de hecho, la parte superior del Monumento a Washington tiene una tapa de 2.8 kg de metal de aluminio, que en ese momento (1884) era la pieza de aluminio elemental más grande jamás aislada. Sin embargo, en 1886, el estadounidense Charles Hall y el francés Paul Héroult elaboraron casi simultáneamente un proceso electrolítico para aislar aluminio de bauxita, un mineral de aluminio cuya fórmula química es AlO x (OH) 3 − 2 x. Las reacciones básicas son las siguientes:
\[Al^{3+} + 3e^− \rightarrow Al_2O^{2−} \rightarrow O_2 + 4e^−\nonumber \]
Con el desarrollo del proceso Hall Héroult, el precio del aluminio bajó por un factor de más de 200, y el aluminio metálico se hizo común. Tanto aluminio elemental se produce en Estados Unidos cada año que se ha estimado que la electrólisis del aluminio utiliza el 5% de toda la electricidad del país. (Reciclar aluminio requiere alrededor de 1/70 la energía de refinar aluminio a partir del mineral, lo que ilustra el tremendo ahorro de energía que proporciona el reciclaje).
Otra aplicación de la electrólisis es la galvanoplastia, que es la deposición de una fina capa de metal sobre un objeto con fines protectores o decorativos (Figura\(\PageIndex{2}\)). Esencialmente, un objeto metálico se conecta al cátodo de una celda electrolítica y se sumerge en una solución de un catión metálico particular. Cuando se opera la celda electrolítica, un recubrimiento delgado del catión metálico se reduce al metal elemental en la superficie del objeto; el espesor del recubrimiento puede ser de tan solo unos pocos micrómetros (10 −6 m). Joyas, utensilios para comer, contactos eléctricos y partes de automóviles como parachoques son artículos comunes que están electrochapados. El oro, la plata, el níquel, el cobre y el cromo son metales comunes utilizados en la galvanoplastia.

Claves para llevar
- La electrólisis es una ocurrencia redox forzada no espontánea por la introducción de electricidad en una celda desde una fuente externa.
- La electrólisis se utiliza para aislar elementos y electrochapar objetos.


