15.3: Vida media
- Page ID
- 74740
- Definir la vida media.
- Determinar la cantidad de sustancia radiactiva que queda después de un número dado de semividas.
Si un isótopo dado es radiactivo o no es una característica de ese isótopo en particular. Algunos isótopos son estables indefinidamente, mientras que otros son radiactivos y se descomponen a través de una forma característica de emisión. A medida que pasa el tiempo, cada vez menos isótopo radiactivo estará presente, y el nivel de radiactividad disminuye. Un aspecto interesante y útil de la desintegración radiactiva es la vida media, que es la cantidad de tiempo que tarda la mitad de un isótopo radiactivo en descomponerse. La vida media de un isótopo radiactivo específico es constante; no se ve afectada por las condiciones y es independiente de la cantidad inicial de ese isótopo.
Considera el siguiente ejemplo. Supongamos que tenemos 100.0 g de tritio (un isótopo radiactivo de hidrógeno). Tiene una vida media de 12.3 y. Después de 12.3 años, la mitad de la muestra habrá decaído de hidrógeno-3 a helio-3 emitiendo una partícula beta, de manera que solo quedan 50.0 g del tritio original. Después de otros 12.3 y —haciendo un total de 24.6 y— otra mitad del tritio restante se habrá descompuesto, dejando 25.0 g de tritio. Después de otros 12.3 y —ahora un total de 36.9 y— otra mitad del tritio restante habrá decaído, dejando 12.5 g. Esta secuencia de eventos se ilustra en la Figura\(\PageIndex{1}\) - Desintegración radiactiva.
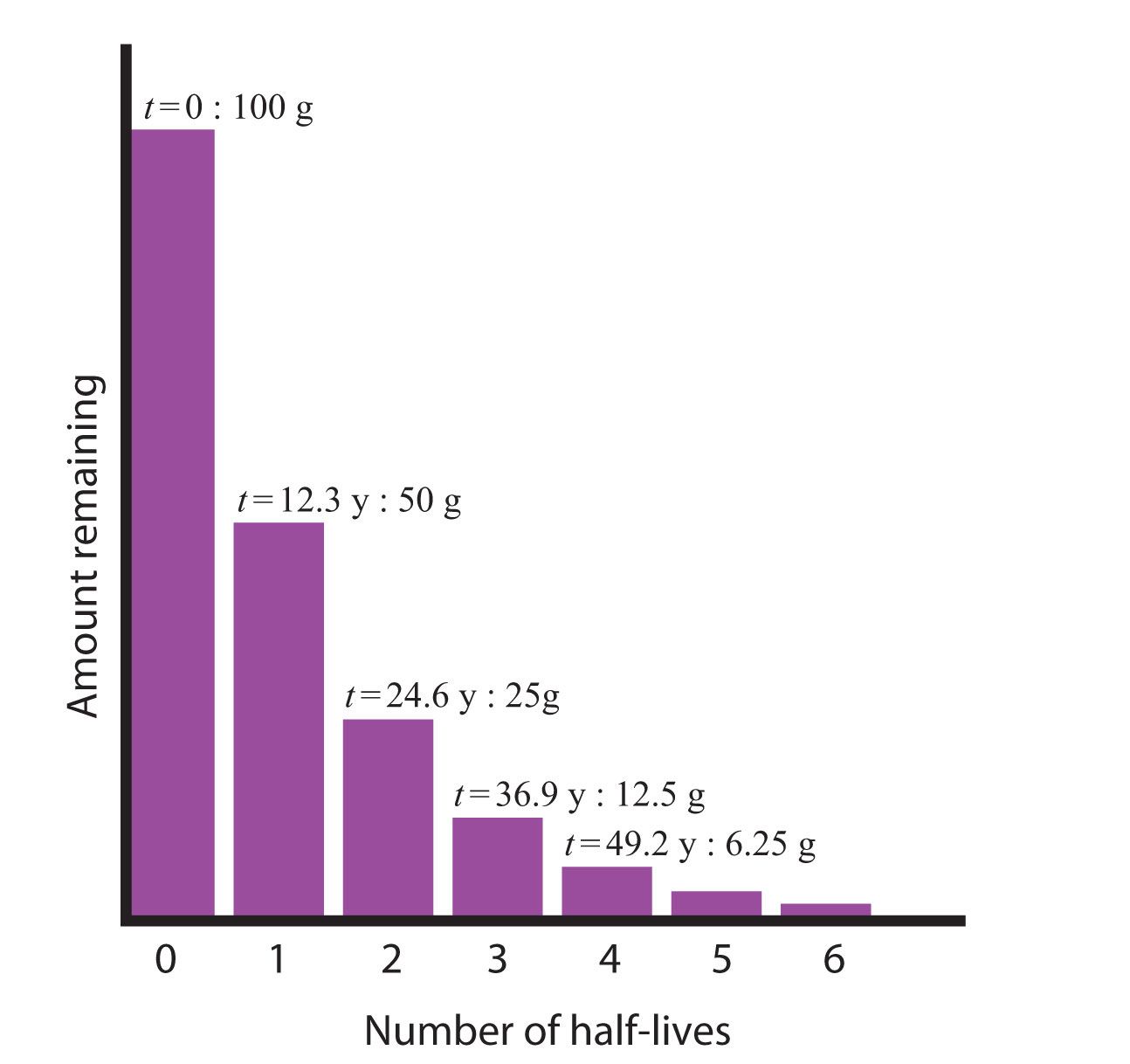
Podemos determinar la cantidad de un isótopo radiactivo que queda después de un número dado de semividas usando la siguiente expresión:
\[\text{amount remaining} = \text{initial amount} \times \left ( \frac{1}{2} \right )^{n}\nonumber \]
donde\(n\) está el número de vidas medias. Esta expresión funciona aunque el número de vidas medias no sea un número entero.
La vida media del fluor-20 es de 11.0 s. Si una muestra contiene inicialmente 5.00 g de fluor-20, ¿cuánto queda después de 44.0 s?
Solución
Si comparamos el tiempo que ha pasado a la vida media del isótopo, observamos que 44.0 s es exactamente 4 semividas, por lo que usamos la expresión anterior n = 4. Sustituir y resolver resultados en lo siguiente:
\[\begin{align*} \text{amount remaining} &= 5.00\,g \times \left ( \frac{1}{2} \right )^{4} \\[4pt] & =\: 5.00\,g\times \left ( \frac{1}{16} \right ) \\[4pt] &= 0.313\,g \end{align*}\nonumber \]
Menos de un tercio de un gramo de fluor-20 queda.
La vida media del titanio-44 es de 60.0 y. Una muestra de titanio contiene 0.600 g de titanio-44. ¿Cuánto queda después de 240.0 y?
- Contestar
-
0.0375 g
Las vidas medias de los isótopos van desde fracciones de microsegundo hasta miles de millones de años. Cuadro\(\PageIndex{1}\) - Semividas de Varios Isótopos, enumera las semividas de algunos isótopos.
| Isótopo | Vida media |
|---|---|
| 3 H | 12.3 y |
| 14 C | 5730 y |
| 40 K | 1.26 × 10 9 y |
| 51 Cr | 27.70 d |
| 90 Sr | 29.1 y |
| 131 I | 8.04 d |
| 222 Rn | 3.823 d |
| 235 U | 7.04 × 10 8 y |
| 238 U | 4.47 × 10 9 y |
| 241 Am | 432.7 y |
| 248 Bk | 23.7 h |
| 260 Sg | 4 ms |
Puede que no te consideres radiactivo, pero lo eres. Una pequeña porción de ciertos elementos en el cuerpo humano son radiactivos y sufren constantemente desintegración. En la siguiente tabla se resume la radiactividad en el cuerpo humano normal.
| Isótopo radiactivo | Vida media (y) | Masa isotópica en el cuerpo (g) | Actividad en el Cuerpo (decae (s) |
|---|---|---|---|
| 40 K | 1.26 × 10 9 | 0.0164 | 4,340 |
| 14 C | 5,730 | 1.6 × 10 −8 | 3,080 |
| 87 Rb | 4.9 × 10 10 | 0.19 | 600 |
| 210 Pb | 22.3 | 5.4 × 10 −10 | 15 |
| 3 H | 12.3 | 2 × 10 −14 | 7 |
| 238 U | 4.47 × 10 9 | 1 × 10 −4 | 5 |
| 228 Ra | 5.76 | 4.6 × 10 −14 | 5 |
| 226 Ra | 1,620 | 3.6 × 10 −11 | 3 |
El cuerpo humano promedio experimenta alrededor de 8,000 desintegraciones radiactivas.
La mayor parte de la radiactividad en el cuerpo humano proviene del potasio-40 y del carbono-14. El potasio y el carbono son dos elementos sin los que absolutamente no podemos vivir, así que a menos que podamos eliminar todos los isótopos radiactivos de estos elementos, no hay forma de escapar al menos alguna radiactividad. Existe un debate sobre qué elemento radiactivo es más problemático. Hay más potasio-40 en el cuerpo que el carbono-14, y tiene una vida media mucho más larga. El potasio-40 también se desintegra con aproximadamente 10 veces más energía que el carbono-14, lo que hace que cada decaimiento sea potencialmente más problemático. Sin embargo, el carbono es el elemento que forma la cadena principal de la mayoría de las moléculas vivas, lo que hace que el carbono-14 sea más probable que esté presente alrededor de moléculas importantes, como las proteínas y las moléculas de ADN. La mayoría de los expertos coinciden en que si bien es insensato esperar absolutamente ninguna exposición a la radiactividad, podemos y debemos minimizar la exposición al exceso de radiactividad.
¿Y si el tiempo transcurrido no es un número exacto de vidas medias? Todavía podemos calcular la cantidad de material que nos queda, pero la ecuación es más complicada. La ecuación es
\[\text{amount remaining} = (\text{amount initial}) \times e^{-0.693t/t_{1/2}}\nonumber \]
donde e es la base de logaritmos naturales (2.71828182...), t es el tiempo transcurrido, y t 1/2 es la vida media del isótopo radiactivo. Las variables t y t 1/2 deben tener las mismas unidades de tiempo, y es posible que deba asegurarse de saber cómo evaluar las potencias de logaritmo natural en su calculadora (para muchas calculadoras, hay una función de “logaritmo inverso” que puede usar; consulte su instructor si no estás seguro de cómo usar tu calculadora). Aunque esta es una fórmula más complicada, el tiempo t no necesita ser un múltiplo exacto de vidas medias.
La vida media del fluor-20 es de 11.0 s. Si una muestra contiene inicialmente 5.00 g de fluor-20, ¿cuánto queda después de 60.0 s?
Solución
Aunque similar al Ejemplo 3, la cantidad de tiempo no es un múltiplo exacto de una vida media. Aquí identificamos la cantidad inicial como 5.00 g, t = 60.0 s, y t 1/2 = 11.0 s. Sustituyendo en la ecuación:
cantidad restante = (5.00 g) × e − (0.693) (60.0 s) /11.0 s
Evaluando al exponente (y señalando que las unidades s cancelan), obtenemos
cantidad restante = (5.00 g) × e −3.78
Resolviendo, la cantidad restante es de 0.114 g. (Quizás quieras verificar esta respuesta para confirmar que estás usando tu calculadora correctamente).
La vida media del titanio-44 es de 60.0 y. Una muestra de titanio contiene 0.600 g de titanio-44. ¿Cuánto queda después de 100.0 y?
- Contestar
-
0.189 g
Claves para llevar
- Los procesos radiactivos naturales se caracterizan por una vida media, el tiempo que tarda la mitad del material en descomponerse radiactivamente.
- La cantidad de material sobrante después de un cierto número de vidas medias se puede calcular fácilmente.


