1.5: Clasificación de la Materia
- Page ID
- 71998
- Describir las fases sólida, líquida y gaseosa.
- Explicar la diferencia entre una sustancia pura y una mezcla.
- Explicar la diferencia entre un elemento y un compuesto.
- Explicar la diferencia entre una mezcla homogénea y una mezcla heterogénea.
Los Estados de la Materia
La materia suele existir en uno de tres estados: sólido, líquido o gas. El estado que una sustancia determinada exhibe es también una propiedad física. Algunas sustancias existen como gases a temperatura ambiente (oxígeno y dióxido de carbono); otras, como el agua y el mercurio metálico, existen como líquidos. La mayoría de los metales existen como sólidos a temperatura ambiente. Todas las sustancias pueden existir en cualquiera de estos tres estados.



Técnicamente hablando, existe un cuarto estado de materia llamado plasma, pero no ocurre naturalmente en la tierra, por lo que lo omitiremos de nuestro estudio aquí.
Sólido
Los sólidos se definen por las siguientes características:
- Forma definida (rígida).
- Volumen definido.
- Las partículas vibran alrededor de ejes fijos.
Si tuviéramos que enfriar el mercurio líquido a su punto de congelación de\(-39^\text{o} \text{C}\), notaríamos que todas las partículas líquidas entran en estado sólido, bajo las condiciones de presión adecuadas. El mercurio se puede solidificar cuando su temperatura se lleva a su punto de congelación. Sin embargo, cuando se devuelve a condiciones de temperatura ambiente, el mercurio no existe en estado sólido por mucho tiempo, y vuelve a su forma líquida más común.
Líquido
Los líquidos tienen las siguientes características:
- Sin forma definida (toma la forma de su contenedor).
- Tiene volumen definido.
- Las partículas son libres de moverse unas sobre otras, pero aún se sienten atraídas entre sí.
Mercurio
El mercurio metálico líquido es una anomalía. Es el único metal conocido que es líquido a temperatura ambiente. El mercurio también tiene la capacidad de adherirse a sí mismo (tensión superficial), una propiedad que todos los líquidos exhiben. El mercurio tiene una tensión superficial relativamente alta, lo que lo hace muy único. En el siguiente video, se ve mercurio en su forma líquida común.
Video\(\PageIndex{1}\): Mercurio hirviendo para convertirse en un gas.
Si calentamos el mercurio líquido a su punto de ebullición de\(357^\text{o} \text{C}\), bajo las condiciones de presión adecuadas, todas las partículas en estado líquido pasarían al estado gaseoso.
Gas
Los gases tienen las siguientes características:
- Sin forma definida (toma la forma de su contenedor).
- Sin volumen definido.
- Las partículas se mueven en movimiento aleatorio con poca o ninguna atracción entre sí.
- Altamente compresible.
Las características de los tres estados de la materia se listan en la Tabla\(\PageIndex{1}\) y se muestra una animación del movimiento y posición de las partículas individuales en la Figura\(\PageIndex{2}\)
| Características | Sólidos | Líquidos | Gases |
|---|---|---|---|
| forma | definido | indefinido | indefinido |
| volumen | definido | definido | indefinido |
| fuerza de interacción intermolecular relativa | fuerte | moderado | débil |
| posiciones relativas de las partículas | en contacto y fijo en su lugar | en contacto, pero no fijo | no en contacto, posiciones aleatorias |
| Imágenes | ||
|---|---|---|
| El estado gaseoso | El estado líquido | El estado sólido |
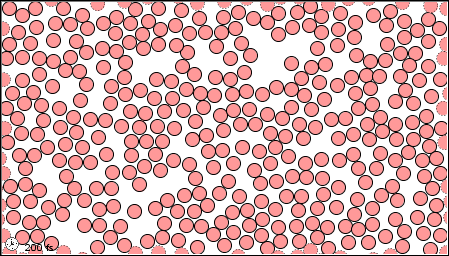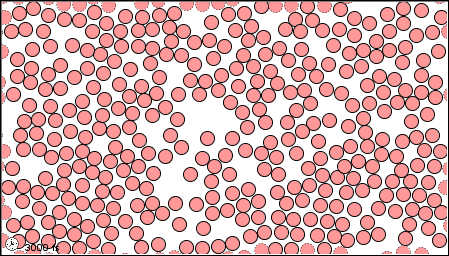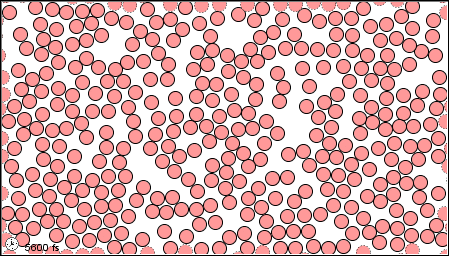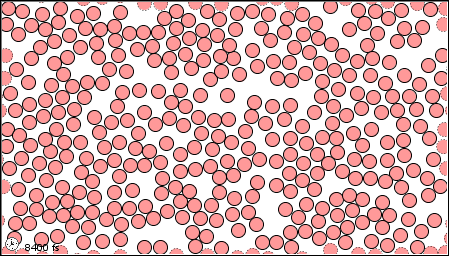 |
 |
|
Figura \(\PageIndex{2}\)Un modelo microscópico que muestra partículas (átomos o moléculas) en los estados gaseoso, líquido y sólido.
¿Qué estado (s) de la materia describe cada enunciado?
- Este estado tiene un volumen definido, pero no una forma definida.
- Este estado no tiene un volumen definido.
- Este estado permite que las partículas individuales se muevan mientras permanecen en contacto.
Solución
- Esta afirmación describe el estado líquido.
- En este comunicado se describe el estado del gas.
- Esta afirmación describe el estado líquido.
¿Qué estado o estados de materia describe cada enunciado?
- Este estado tiene partículas individuales en una posición fija unas con respecto a otras.
- Este estado tiene partículas individuales muy separadas entre sí en el espacio.
- Este estado tiene una forma definida.
- Respuesta a:
- sólido
- Respuesta b:
- gas
- Respuesta c:
- sólido
Sustancias y Mezclas
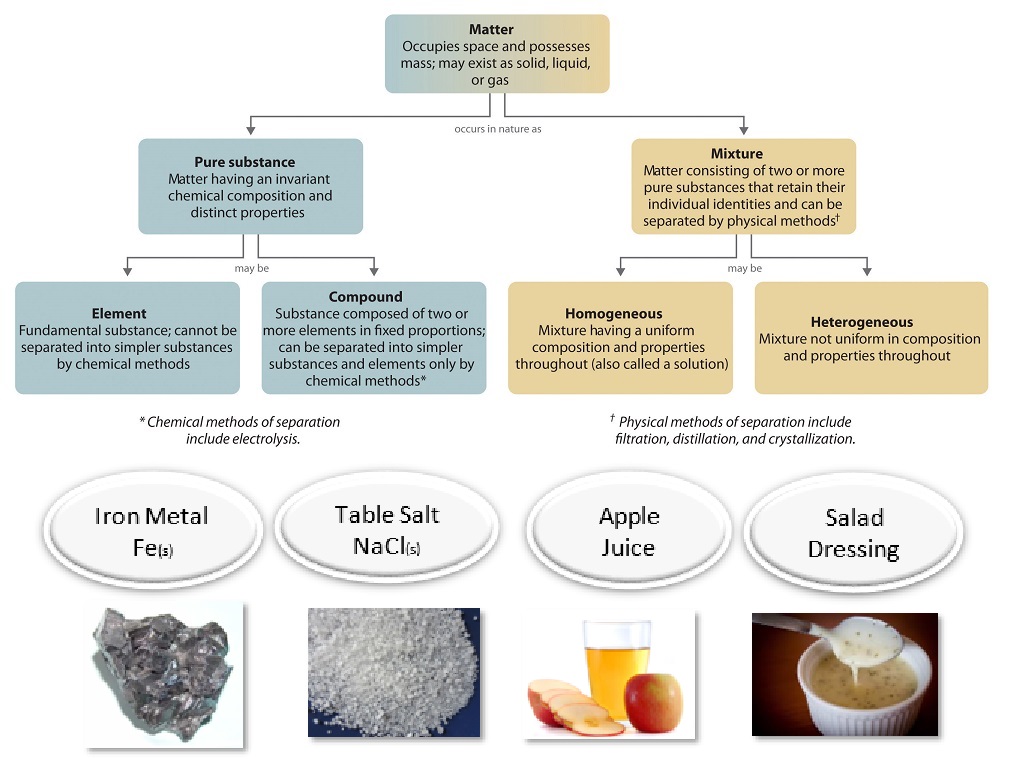
Una manera útil de organizar nuestra comprensión de la materia es pensar en una jerarquía que se extiende desde lo más general y complejo, hasta lo más simple y fundamental (Figura\(\PageIndex{1}\)). La materia puede clasificarse en dos amplias categorías: sustancias puras y mezclas. Una sustancia pura es una forma de materia que tiene una composición constante (es decir, es la misma en todas partes) y propiedades que son constantes en toda la muestra (es decir, solo hay un conjunto de propiedades como punto de fusión, color, punto de ebullición, etc. en toda la materia). Un material compuesto por dos o más sustancias es una mezcla.
La sal de mesa ordinaria se llama cloruro de sodio. Se considera una sustancia porque tiene una composición uniforme y definida. Todas las muestras de cloruro de sodio son químicamente idénticas. El agua también es una sustancia pura. La sal se disuelve fácilmente en agua, pero el agua salada no puede clasificarse como sustancia porque su composición puede variar. Puede disolver una cantidad pequeña o grande de sal en una cantidad dada de agua. Una mezcla es una mezcla física de dos o más componentes, cada uno de los cuales conserva su propia identidad y propiedades en la mezcla. Sólo se cambia la forma de la sal cuando se disuelve en agua. Conserva su composición y propiedades.
Una mezcla homogénea es una mezcla en la que la composición es uniforme en toda la mezcla. El agua salada descrita anteriormente es homogénea debido a que la sal disuelta se distribuye uniformemente por toda la muestra de agua salada. Muchas veces es fácil confundir una mezcla homogénea con una sustancia pura, porque ambas son uniformes. La diferencia es que la composición de la sustancia es siempre la misma. La cantidad de sal en el agua salada puede variar de una muestra a otra. Todas las soluciones se considerarían homogéneas porque el material disuelto está presente en la misma cantidad en toda la solución.
Una mezcla heterogénea es una mezcla en la que la composición no es uniforme en toda la mezcla. La sopa de verduras es una mezcla heterogénea. Cualquier cucharada dada de sopa contendrá cantidades variables de las diferentes verduras y otros componentes de la sopa.
Elementos y Compuestos
Elementos y compuestos son ambos ejemplos de sustancias puras. Una sustancia que no se puede descomponer en componentes químicamente más simples es un elemento. El aluminio, que se utiliza en latas de soda, es un elemento. Una sustancia que se puede descomponer en componentes químicamente más simples (porque tiene más de un elemento) es un compuesto. Por ejemplo, el agua es un compuesto compuesto por los elementos hidrógeno y oxígeno. Hoy en día, hay alrededor de 118 elementos en el universo conocido. En contraste, los científicos han identificado decenas de millones de compuestos diferentes hasta la fecha.
Video \(\PageIndex{2}\)Átomos, elementos y compuestos (primeros cinco minutos de video)
Una fase es cualquier parte de una muestra que tenga una composición y propiedades uniformes. Por definición, una sustancia pura o una mezcla homogénea consiste en una sola fase. Una mezcla heterogénea consta de dos o más fases. Cuando se combinan aceite y agua, no se mezclan uniformemente, sino que forman dos capas separadas. Cada una de las capas se llama fase.
Identificar cada sustancia como un compuesto, un elemento, una mezcla heterogénea o una mezcla homogénea (solución).
- té filtrado
- jugo de naranja recién exprimido
- un disco compacto
- óxido de aluminio (un polvo blanco que contiene una proporción 2:3 de átomos de aluminio y oxígeno)
- selenio
Dado: una sustancia química.
Preguntado por: su clasificación.
Estrategia:
- Decidir si una sustancia es químicamente pura. Si es pura, la sustancia es o bien un elemento o un compuesto. Si una sustancia se puede separar en sus elementos, es un compuesto.
- Si una sustancia no es químicamente pura, es o bien una mezcla heterogénea o una mezcla homogénea. Si su composición es uniforme en todo momento, es una mezcla homogénea.
Solución:
- A) El té es una solución de compuestos en agua, por lo que no es químicamente puro. Por lo general, se separa de las hojas de té por filtración.
B) Debido a que la composición de la solución es uniforme en todo momento, es una mezcla homogénea. - A) El jugo de naranja contiene partículas de sólidos (pulpa) así como líquidos; no es químicamente puro.
B) Debido a que su composición no es uniforme en todo momento, el jugo de naranja es una mezcla heterogénea. - A) Un disco compacto es un material sólido que contiene más de un elemento, con regiones de diferentes composiciones visibles a lo largo de su borde. De ahí que un disco compacto no sea químicamente puro.
B) Las regiones de diferente composición indican que un disco compacto es una mezcla heterogénea. - A) El óxido de aluminio es un compuesto único, químicamente puro.
- A) El selenio es uno de los elementos conocidos.
Identificar cada sustancia como un compuesto, un elemento, una mezcla heterogénea o una mezcla homogénea (solución).
- vino blanco
- mercurio
- aderezo para ensaladas estilo rancho
- azúcar de mesa (sacarosa)
- Respuesta a:
- mezcla homogénea (solución)
- Respuesta b:
- elemento
- Respuesta c:
- mezcla heterogénea
- Respuesta d:
- compuesto
¿Cómo categorizaría un químico cada ejemplo de materia?
- agua salada
- suelo
- agua
- oxígeno
Solución
- El agua salada actúa como si se tratara de una sola sustancia a pesar de que contiene dos sustancias: sal y agua. El agua salada es una mezcla homogénea, o una solución.
- El suelo está compuesto por pequeños trozos de una variedad de materiales, por lo que es una mezcla heterogénea.
- El agua es una sustancia; más específicamente, debido a que el agua está compuesta por hidrógeno y oxígeno, es un compuesto.
- El oxígeno, una sustancia, es un elemento.
¿Cómo categorizaría un químico cada ejemplo de materia?
- café filtrado
- hidrógeno
- un huevo
- Respuesta a:
- una mezcla homogénea (solución)
- Respuesta b:
- elemento
- Respuesta c:
- mezcla heterogénea.
Resumen
- Existen tres estados de la materia: sólido, líquido y gas.
- Los sólidos tienen una forma y volumen definidos.
- Los líquidos tienen un volumen definido, pero toman la forma del contenedor.
- Los gases no tienen forma ni volumen definidos
- La materia puede clasificarse en dos amplias categorías: sustancias puras y mezclas.
- Una sustancia pura es una forma de materia que tiene una composición constante, y propiedades que son constantes en toda la muestra.
- Las mezclas son combinaciones físicas de dos o más elementos y/o compuestos.
- Las mezclas pueden clasificarse como homogéneas o heterogéneas.
- Elementos y compuestos son ambos ejemplos de sustancias puras. Los compuestos son sustancias que están compuestas por más de un tipo de átomo. Los elementos son las sustancias más simples compuestas por un solo tipo de átomo.
Colaboradores y Atribuciones
CK-12 Foundation by Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson, and Jean Dupon.
Stephen Lower, Professor Emeritus (Simon Fraser U.) Chem1 Virtual Textbook
Ed Vitz (Kutztown University), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (University of Minnesota Rochester), Tim Wendorff, and Adam Hahn.
Henry Agnew (UC Davis)


