1.6: La Medición de la Materia
- Page ID
- 71997
- Exprese las cantidades correctamente, usando un número y una unidad.
- Indicar los diferentes sistemas de medición utilizados en química.
- Expresar un número grande o un número pequeño en notación científica.
- Aprende a usar prefijos SI.
- Realizar conversiones de unidades usando factores de conversión.
Las instrucciones de una cafetera te indican que llenes la cafetera con 4 tazas de agua y uses 3 bolas de café. Cuando sigues estas instrucciones, estás midiendo. Cuando visitas el consultorio de un médico, una enfermera verifica tu temperatura, altura, peso y quizás presión arterial (Figura\(\PageIndex{1}\)); la enfermera también está midiendo.
Los químicos miden las propiedades de la materia y expresan estas medidas como cantidades. Una cantidad es una cantidad de algo, y consiste en un número y una unidad. El número nos dice cuántos (o cuánto), y la unidad nos dice cuál es la escala de medida. Por ejemplo, cuando una distancia se reporta como “5 kilómetros”, sabemos que la cantidad se ha expresado en unidades de kilómetros y que el número de kilómetros es de 5. Si le preguntas a un amigo qué tan lejos anda de casa a la escuela, y el amigo contesta “12” sin especificar una unidad, no sabes si tu amigo camina 12 millas, 12 kilómetros, 12 estamentos, o 12 yardas... etc. Se debe incluir tanto un número como una unidad para expresar una cantidad adecuadamente.
Para entender la química, necesitamos una comprensión clara de las unidades con las que trabajan los químicos y las reglas que siguen para expresar números. En las dos secciones siguientes se examinan las reglas para expresar números.
Todas las mediciones dependen del uso de unidades que son bien conocidas y entendidas. El sistema inglés de unidades de medida (pulgadas, pies, onzas, etc.) no se utilizan en la ciencia debido a la dificultad de convertir de una unidad a otra. El sistema métrico se utiliza porque todas las unidades métricas se basan en múltiplos de 10, haciendo que las conversiones sean muy simples. El sistema métrico se estableció originalmente en Francia en 1795. El Sistema Internacional de Unidades es un sistema de medición basado en el sistema métrico. El acrónimo SI se usa comúnmente para referirse a este sistema y significa el término francés, Le Système International d'Unités. El SI fue adoptado por acuerdo internacional en 1960 y está compuesto por las siete unidades base que se muestran en la Tabla\(\PageIndex{1}\).
| Cantidad | Unidad Base SI | Símbolo |
|---|---|---|
| Largo | medidor | \(\text{m}\) |
| Masa | kilogramo | \(\text{kg}\) |
| Temperatura | kelvin | \(\text{K}\) |
| Tiempo | segundo | \(\text{s}\) |
| Cantidad de una Sustancia | mole | \(\text{mol}\) |
| Corriente Eléctrica | amperio | \(\text{A}\) |
| Intensidad luminosa | candela | \(\text{cd}\) |
Las primeras unidades se encuentran frecuentemente en química. Todas las demás cantidades de medición, como el volumen, la fuerza y la energía, se pueden derivar de estas siete unidades base.
Números Exponenciales: Poderes de Diez
Los químicos suelen trabajar con números que son extremadamente grandes o pequeños. Por ejemplo, ingresar la masa en gramos de un átomo de hidrógeno en una calculadora requeriría una visualización con al menos 24 decimales. Un sistema llamado notación científica evita gran parte del tedio y la incomodidad de manipular números con magnitudes grandes o pequeñas. Además, el uso de prefijos es otra forma de expresar mediciones que involucran números grandes y pequeños.
Notación Científica
En notación científica, los números se expresan en la forma
\[ N \times 10^n \nonumber \]
donde N es mayor o igual a 1 y menor que 10 (1 ≤ N < 10), y n es un entero positivo o negativo (10 0 = 1). Al número 10 se le llama base porque es este número el que se eleva a la potencia\(n\). Aunque un número base puede tener valores distintos a 10, el número base en notación científica es siempre 10.
Una forma sencilla de convertir números a notación científica es mover el punto decimal tantos lugares a la izquierda o a la derecha como sea necesario para dar un número del 1 al 10 (N). La magnitud de n se determina entonces de la siguiente manera:
- Si el punto decimal se mueve a la izquierda n lugares, n es positivo.
- Si el punto decimal se mueve a la derecha n lugares, n es negativo.
Otra forma de recordar esto es reconocer que a medida que el número N disminuye en magnitud, el exponente aumenta y viceversa. La aplicación de esta regla se ilustra en Ejemplo\(\PageIndex{1}\).
Convertir cada número a notación científica.
- 637.8
- 0.0479
- 12,378
- 0.00032
Solución
| Explicación | Contestar | |
|---|---|---|
| a |
Para convertir 637.8 a un número del 1 al 10, movemos el punto decimal dos lugares a la izquierda: 637.8 Debido a que el punto decimal se movió dos lugares a la izquierda, n = 2. |
\(6.378 \times 10^2\) |
| b |
Para convertir 0.0479 a un número del 1 al 10, movemos el punto decimal dos lugares a la derecha: 0.0479 Debido a que el punto decimal se movió dos lugares a la derecha, n = −2. |
\(4.79 \times 10^{−2}\) |
| c | Debido a que el punto decimal se movió cuatro lugares a la izquierda, n = 4. | \(1.2378 \times 10^4\) |
| d | Debido a que el punto decimal se movió cuatro lugares a la derecha, n = −4. | \(3.2 \times 10^{−4}\) |
Convertir cada número ordinario a notación científica, o viceversa.
- 67,000,000,000
- 1,689
- 12.6
- Contestar a
- 6.7 × 10 10
- Respuesta b
- 1.689 × 10 3
- Respuesta c
- 1.26 × 10 1
Convertir cada número ordinario a notación científica, o viceversa.
- 0.000006567
- 6.22 × 10 −2
- 9.9 × 10 −9
- Contestar a
- 6.567 × 10 −6
- Respuesta b
- 0.0622
- Respuesta c
- 0.0000000099
Prefijos métricos
Las conversiones entre unidades métricas del sistema son sencillas porque el sistema se basa en potencias de diez. Por ejemplo, los metros, centímetros y milímetros son todas unidades métricas de longitud. Hay 10 milímetros en 1 centímetro y 100 centímetros en 1 metro. Los prefijos métricos se utilizan para distinguir entre unidades de diferente tamaño. Todos estos prefijos derivan de términos latinos o griegos. Por ejemplo, mega viene de la palabra griega\(\mu \varepsilon \gamma \alpha \varsigma\), que significa “genial”. Tabla\(\PageIndex{2}\) enumera los prefijos métricos más comunes y su relación con la unidad central que no tiene prefijo. La longitud se utiliza como ejemplo para demostrar el tamaño relativo de cada unidad prefijada.
| Prefijo | Abreviatura de unidades | Significado | Ejemplo |
|---|---|---|---|
| giga | \(\text{G}\) | 1,000,000,000 | 1 Gigámetro\(\left( \text{Gm} \right)=10^9 \: \text{m}\) |
| mega | \(\text{M}\) | 1,000,000 | 1 megametro\(\left( \text{Mm} \right)=10^6 \: \text{m}\) |
| kilo | \(\text{k}\) | 1,000 | 1 kilómetro\(\left( \text{km} \right)=1,000 \: \text{m}\) |
| hecto | \(\text{h}\) | 100 | 1 hectómetro\(\left( \text{hm} \right)=100 \: \text{m}\) |
| deka | \(\text{da}\) | 10 | 1 dekameter\(\left( \text{dam} \right)=10 \: \text{m}\) |
| 1 | 1 metro\(\left( \text{m} \right)\) | ||
| deci | \(\text{d}\) | 1/10 | 1 decímetro\(\left( \text{dm} \right)=0.1 \: \text{m}\) |
| centi | \(\text{c}\) | 1/100 | 1 centímetro\(\left( \text{cm} \right)=0.01 \: \text{m}\) |
| milli | \(\text{m}\) | 1/1,000 | 1 milímetro\(\left( \text{mm} \right)=0.001 \: \text{m}\) |
| micro | \(\mu\) | 1/1,000,000 | 1 micrómetro\(\left( \mu \text{m} \right)=10^{-6} \: \text{m}\) |
| nano | \(\text{n}\) | 1/1,000,000,000 | 1 nanómetro\(\left( \text{nm} \right)=10^{-9} \: \text{m}\) |
| pico | \(\text{p}\) | 1/1,000,000,000,000 | 1 picómetro\(\left( \text{pm} \right)=10^{-12} \: \text{m}\) |
Hay un par de pequeñas prácticas extrañas con el uso de abreviaturas métricas. La mayoría de las abreviaturas son minúsculas. Utilizamos "\(\text{m}\)" para medidor y no "\(\text{M}\)”. No obstante, cuando se trata de volumen, la unidad base “litro” se abrevia como "\(\text{L}\)" y no "\(\text{l}\)”. Entonces, 3.5 mililitros se escribe como\(3.5 \: \text{mL}\).
Como cuestión práctica, siempre que sea posible, debes expresar las unidades en un número pequeño y manejable. Si estás midiendo el peso de un material que pesa\(6.5 \: \text{kg}\), esto es más fácil que decir que pesa\(6500 \: \text{g}\) o\(0.65 \: \text{dag}\). Los tres son correctos, pero las\(\text{kg}\) unidades en este caso hacen que sea un número pequeño y fácil de administrar. No obstante, si un problema específico necesita gramos en lugar de kilogramos, vaya con los gramos para obtener consistencia.
Dar la abreviatura para cada unidad y definir la abreviatura en términos de la unidad base.
- kiloliter
- microsegundo
- decímetro
- nanograma
Soluciones
| Explicación | Contestar | |
|---|---|---|
| a | El prefijo kilo significa “1,000 ×”, así que 1 kL equivale a 1,000 L | kL |
| b | El prefijo micro implica 1/1,000,000th de una unidad, por lo que 1 µs equivale a 0.000001 s. | µs |
| c | El prefijo deci significa 1/10th, entonces 1 dm equivale a 0.1 m. | dm |
| d | El prefijo nano significa 1/1000000000, por lo que un nanogramo es igual a 0.000000001 g | ng |
Dar la abreviatura para cada unidad y definir la abreviatura en términos de la unidad base.
- kilómetro
- miligramo
- nanosegundo
- centilitro
- Respuesta a:
- km
- Respuesta b:
- mg
- Respuesta c:
- ns
- Respuesta d:
- cL
Masa y peso
La masa es una medida de la cantidad de materia que contiene un objeto. La masa de un objeto se realiza en comparación con la masa estándar de 1 kilogramo. El kilogramo se definió originalmente como la masa\(1 \: \text{L}\) de agua líquida a\(4^\text{o} \text{C}\) (el volumen de un líquido cambia ligeramente con la temperatura). En el laboratorio, la masa se mide con una balanza (ver abajo), la cual debe ser calibrada con una masa estándar para que sus mediciones sean precisas.

Otras unidades comunes de masa son el gramo y el miligramo. Un gramo es 1/1000 de kilogramo, es decir, que hay\(1000 \: \text{g}\) en\(1 \: \text{kg}\). Un miligramo es 1/1000 de gramo, por lo que hay\(1000 \: \text{mg}\) en\(1 \: \text{g}\).
La masa a menudo se confunde con el término peso. El peso es una medida de fuerza que es igual a la atracción gravitacional sobre un objeto. El peso de un objeto depende de su ubicación. En la luna, la fuerza debida a la gravedad es aproximadamente una sexta parte de la fuerza gravitacional en la Tierra. Por lo tanto, un objeto dado pesará seis veces más en la Tierra que en la luna. Dado que la masa depende únicamente de la cantidad de materia presente en un objeto, la masa no cambia con la ubicación. Las mediciones de peso a menudo se realizan con una báscula de resorte, leyendo la distancia que un determinado objeto tira hacia abajo y estira un resorte.
Largo y Volumen
La longitud es la medida de la extensión de algo a lo largo de su mayor dimensión. La unidad básica de longitud SI, o medida lineal, es el medidor\(\left( \text{m} \right)\). Todas las medidas de longitud se pueden hacer en metros, aunque los prefijos enumerados en varias tablas a menudo serán más convenientes. El ancho de una habitación puede expresarse como unos 5 metros\(\left( \text{m} \right)\), mientras que una gran distancia, como la distancia entre la ciudad de Nueva York y Chicago, se expresa mejor como 1150 kilómetros\(\left( \text{km} \right)\). Distancias muy pequeñas se pueden expresar en unidades como el milímetro o el micrómetro. El ancho de un cabello humano típico es de aproximadamente 10 micrómetros\(\left( \mu \text{m} \right)\).

Volumen es la cantidad de espacio ocupado por una muestra de materia. El volumen de un objeto regular se puede calcular multiplicando su longitud por su anchura y su altura. Dado que cada una de esas es una medida lineal, decimos que las unidades de volumen se derivan de unidades de longitud. La unidad de volumen SI es el metro cúbico\(\left( \text{m}^3 \right)\), que es el volumen ocupado por un cubo que mide\(1 \: \text{m}\) en cada lado. Este volumen muy grande no es muy conveniente para su uso típico en un laboratorio de química. Un litro\(\left( \text{L} \right)\) es el volumen de un cubo que mide\(10 \: \text{cm}\)\(\left( 1 \: \text{dm} \right)\) en cada lado. Un litro es así igual a ambos\(1000 \: \text{cm}^3\)\(\left( 10 \: \text{cm} \times 10 \: \text{cm} \times 10 \: \text{cm} \right)\) y a\(1 \: \text{dm}^3\).
1L =\(1000 \: \text{cm}^3\)\(\left( 10 \: \text{cm} \times 10 \: \text{cm} \times 10 \: \text{cm} \right)\) =\(1 \: \text{dm}^3\)
Una unidad de volumen más pequeña que se usa comúnmente es el mililitro (\(\text{mL}\)). Un mililitro es el volumen de un cubo que mide\(1 \: \text{cm}\) en cada lado. Por lo tanto, un mililitro es igual a un centímetro cúbico\(\left( \text{cm}^3 \right)\).
1 mL\(\left( \text{cm}^3 \right)\)
Hay\(1000 \: \text{mL}\) en\(1 \: \text{L}\), que es lo mismo que decir que hay\(1000 \: \text{cm}^3\) en\(1 \: \text{dm}^3\).


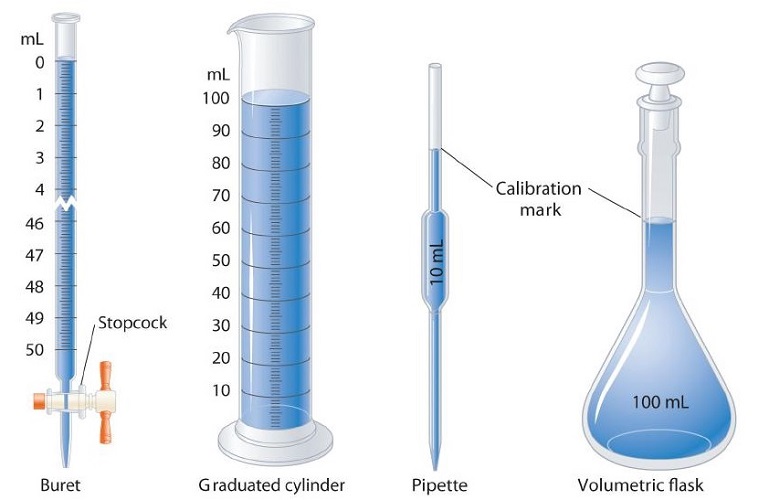
Durante tus estudios de química (y física también), notarás que las ecuaciones matemáticas se utilizan en muchas aplicaciones diferentes. Muchas de estas ecuaciones tienen una serie de variables diferentes con las que necesitarás trabajar. También debes tener en cuenta que estas ecuaciones a menudo requerirán que uses medidas con sus unidades. ¡Las habilidades de álgebra se vuelven muy importantes aquí!
Conversión entre unidades con factores de conversión
Un factor de conversión es un factor utilizado para convertir una unidad de medida en otra. Se puede usar un factor de conversión simple para convertir metros en centímetros, o uno más complejo se puede usar para convertir millas por hora en metros por segundo. Dado que la mayoría de los cálculos requieren que las mediciones estén en ciertas unidades, encontrará muchos usos para los factores de conversión. Recuerda siempre que un factor de conversión tiene que representar un hecho; este hecho puede ser simple o mucho más complejo. Por ejemplo, ya sabes que 12 huevos equivalen a una docena. Un hecho más complejo es que la velocidad de la luz es de\(1.86 \times 10^5\) millas/seg. Cualquiera de estos se puede utilizar como factor de conversión, dependiendo del tipo de cálculo con el que pueda estar trabajando (Tabla\(\PageIndex{1}\)).
| Unidades inglesas | Unidades Métricas | Cantidad |
|---|---|---|
| 1 onza (oz) | 28.35 gramos (g) | *masa |
| 1 líquido una vez (oz) | 2.96 mL | volumen |
| 2.205 libras (lb) | 1 kilogramo (kg) | *masa |
| 1 pulgada (pulg.) | 2.54 centímetros (cm) | longitud |
| 0.6214 millas (mi) | 1 kilómetro (km) | longitud |
| 1 cuarto (qt) | 0.95 litros (L) | volumen |
*Las libras y onzas son técnicamente unidades de fuerza, no de masa, pero este hecho suele ser ignorado por la comunidad no científica.
Por supuesto, hay otras proporciones que no están listadas en la Tabla\(\PageIndex{1}\). Pueden incluir:
- Ratios incrustados en el texto del problema (usando palabras como per o en cada uno, o usando símbolos como/o%).
- Conversiones en el sistema métrico, como se trató anteriormente en este capítulo.
- Ratios de conocimiento común (como 60 segundos\(=\) 1 minuto).
Si aprendiste las unidades SI y prefijos descritos, entonces sabes que 1 cm es 1/100 de metro.
\[ 1\; \rm{cm} = \dfrac{1}{100} \; \rm{m} = 10^{-2}\rm{m} \nonumber \]
o
\[100\; \rm{cm} = 1\; \rm{m} \nonumber \]
Supongamos que dividimos ambos lados de la ecuación por\(1 \text{m}\) (tanto el número como la unidad):
\[\mathrm{\dfrac{100\:cm}{1\:m}=\dfrac{1\:m}{1\:m}} \nonumber \]
Siempre y cuando realicemos la misma operación en ambos lados del signo de iguales, la expresión sigue siendo una igualdad. Mira el lado derecho de la ecuación; ahora tiene la misma cantidad en el numerador (la parte superior) que en el denominador (la parte inferior). Cualquier fracción que tenga la misma cantidad en el numerador y el denominador tiene un valor de 1:
\[ \dfrac{ \text{100 cm}}{\text{1 m}} = \dfrac{ \text{1000 mm}}{\text{1 m}}= \dfrac{ 1\times 10^6 \mu \text{m}}{\text{1 m}}= 1 \nonumber \]
Sabemos que 100 cm es de 1 m, por lo que tenemos la misma cantidad en la parte superior e inferior de nuestra fracción, aunque se expresa en diferentes unidades.
Realización de Análisis Dimensional
El análisis dimensional es una de las herramientas más valiosas utilizadas por los científicos físicos. En pocas palabras, es la conversión entre una cantidad en una unidad a la cantidad correspondiente en una unidad deseada, utilizando diversos factores de conversión. Esto es valioso porque ciertas mediciones son más precisas o más fáciles de encontrar que otras. El uso de unidades en un cálculo para asegurar que obtenemos las unidades adecuadas finales se denomina análisis dimensional.
Aquí un ejemplo sencillo: ¿Cuántos centímetros hay en 3.55 m? Quizás puedas determinar la respuesta en tu cabeza. Si hay 100 cm en cada metro, entonces 3.55 m equivale a 355 cm. Para resolver el problema de manera más formal con un factor de conversión, primero escribimos la cantidad que nos dan, 3.55 m. Luego multiplicamos esta cantidad por un factor de conversión, que es lo mismo que multiplicarla por 1. Podemos escribir 1 como\(\mathrm{\frac{100\:cm}{1\:m}}\) y multiplicar:
\[ 3.55 \; \rm{m} \times \dfrac{100 \; \rm{cm}}{1\; \rm{m}} \nonumber \]
Los 3.55 m se pueden considerar como una fracción con un 1 en el denominador. Debido a que m, la abreviatura de metros, aparece tanto en el numerador como en el denominador de nuestra expresión, cancelan:
\[\dfrac{3.55 \; \cancel{\rm{m}}}{ 1} \times \dfrac{100 \; \rm{cm}}{1 \; \cancel{\rm{m}}} \nonumber \]
El paso final es realizar el cálculo que queda una vez canceladas las unidades:
\[ \dfrac{3.55}{1} \times \dfrac{100 \; \rm{cm}}{1} = 355 \; \rm{cm} \nonumber \]
En la respuesta final, omitimos el 1 en el denominador. Así, por un procedimiento más formal, encontramos que 3.55 m equivale a 355 cm. Una descripción generalizada de este proceso es la siguiente:
cantidad (en unidades antiguas) × factor de conversión = cantidad (en unidades nuevas)
Quizás se esté preguntando por qué usamos un procedimiento aparentemente complicado para una conversión sencilla. En estudios posteriores, los problemas de conversión que encontrarás no siempre serán tan sencillos. Si puedes dominar la técnica de aplicar factores de conversión, podrás resolver una gran variedad de problemas.
En el ejemplo anterior, se utilizó la fracción\(\frac{100 \; \rm{cm}}{1 \; \rm{m}}\) como factor de conversión. ¿El factor de conversión\(\frac{1 \; \rm m}{100 \; \rm{cm}}\) también es igual a 1? Sí, lo hace; tiene la misma cantidad en el numerador que en el denominador (salvo que se expresan en diferentes unidades). ¿Por qué no usamos ese factor de conversión? Si hubiéramos utilizado el segundo factor de conversión, la unidad original no habría cancelado, y el resultado no tendría sentido. Esto es lo que habríamos conseguido:
\[ 3.55 \; \rm{m} \times \dfrac{1\; \rm{m}}{100 \; \rm{cm}} = 0.0355 \dfrac{\rm{m}^2}{\rm{cm}} \nonumber \]
Para que la respuesta sea significativa, tenemos que construir el factor de conversión en una forma que haga que la unidad original se cancele. La figura\(\PageIndex{1}\) muestra un mapa conceptual para construir una conversión adecuada.
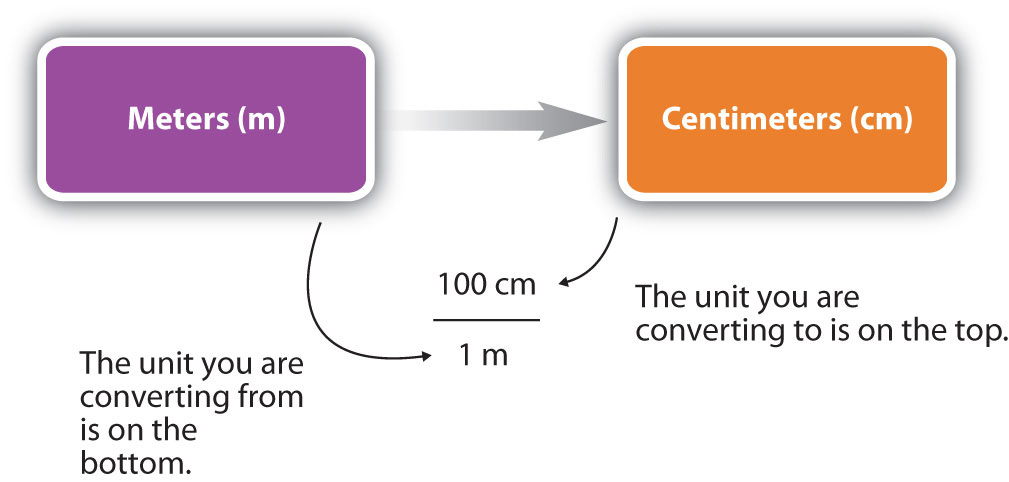
- Identificar la información "dada" en el problema. Busque un número con unidades para comenzar este problema.
- ¿Cuál es el problema de pedirte que "encuentres “? Es decir, ¿qué unidad tendrá tu respuesta?
- Usa ratios y factores de conversión para cancelar las unidades que no forman parte de tu respuesta y dejarte con unidades que forman parte de tu respuesta.
- Cuando tus unidades cancelen correctamente, estás listo para hacer los cálculos. Estás multiplicando fracciones, así multiplicas los números superiores y divides por los números inferiores en las fracciones.
| Ejemplo\(\PageIndex{2}\) | Ejemplo\(\PageIndex{3}\) | |
|---|---|---|
| Pasos para la resolución de problemas | \ (\ PageIndex {2}\)” style="text-align:center; vertical-align:middle; ">El volumen promedio de sangre en un macho adulto es 4.7 L. ¿Cuál es este volumen en galones? | \ (\ pageIndex {3}\)” style="text-align:center; vertical-align:middle; ">Un colibrí puede aletear sus alas una vez en 18 ms. ¿Cuántos segundos hay en 18 ms? |
| Identifica la información “dada” y cuál es el problema que te pide “encontrar”. | \ (\ pageIndex {2}\)” style="text-align:center; vertical-align:middle; ">Dado: 4.7 L Buscar: gal |
\ (\ pageIndex {3}\)” style="text-align:center; vertical-align:middle; ">Dado: 18 ms Buscar: s |
| Enumere otras cantidades conocidas. | \ (\ pageIndex {2}\)” style="text-align:center; vertical-align:middle; ">\(1\, L = 3.785 gal \) | \ (\ pageIndex {3}\)” style="text-align:center; vertical-align:middle; ">\(1 \,ms = 10^{-3} s \) |
| Preparar un mapa conceptual y utilizar el factor de conversión adecuado. | \ (\ PageIndex {2}\)” style="vertical-align:middle; "> |
\ (\ PageIndex {3}\)” style="vertical-align:middle; ">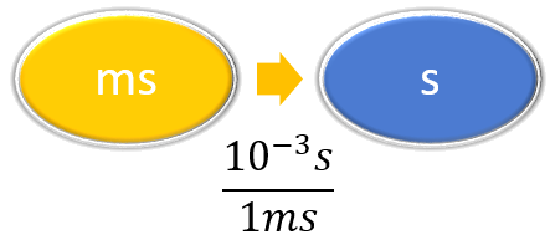 |
| Cancelar unidades y calcular. | \ (\ pageIndex {2}\)” style="text-align:center; vertical-align:middle; ">\( 4.7 \cancel{\rm{L}} \times \dfrac{1 \; \rm{gal}}{3.785\; \cancel{\rm{L}}} = 1.2\; \rm{gal}\) | \ (\ PageIndex {3}\)” style="vertical-align:middle; ">
\( 18 \; \cancel{\rm{ms}} \times \dfrac{10^{-3}\; \rm{s}}{1 \; \cancel{\rm{ms}}} = 0.018\; \rm{s}\) o \( 18 \; \cancel{\rm{ms}} \times \dfrac{1\; \rm{s}}{1,000 \; \cancel{\rm{ms}}} = 0.018\; \rm{s}\) |
| Piensa en tu resultado. | \ (\ pageIndex {2}\)” style="text-align:center; vertical-align:middle; ">La cantidad en gal debe ser ligeramente menor que 4 veces menor que la cantidad dada en L. | \ (\ pageIndex {3}\)” style="vertical-align:middle; ">La cantidad en s debe ser 1/1000 la cantidad dada en ms. |
Realiza cada conversión.
- 101,000 ns a segundos
- 32.08 kg a gramos
- 1.53 gramos a cg
- Respuesta a:
- \(1.01000 x 10^{-4} s \)
- Respuesta b:
- \(3.208 x 10^{4} g \)
- Respuesta c:
- \(1.53 x 10^{2} g \)
Conversiones múltiples
En ocasiones tendrás que realizar más de una conversión para obtener la unidad deseada. Por ejemplo, supongamos que desea convertir 54.7 km en milímetros. Configuraremos una serie de factores de conversión para que cada factor de conversión produzca la siguiente unidad en la secuencia. W e primero convierte la cantidad dada en km a la unidad base, que es metros. Sabemos que 1,000 m =1 km. Después convertimos metros a mm, recordando que\(1\; \rm{mm}\) =\( 10^{-3}\; \rm{m}\).
Mapa conceptual
Cálculo
\[ \begin{align} 54.7 \; \cancel{\rm{km}} \times \dfrac{1,000 \; \cancel{\rm{m}}}{1\; \cancel{\rm{km}}} \times \dfrac{1\; \cancel{\rm{mm}}}{\cancel{10^{-3} \rm{m}}} & = 54,700,000 \; \rm{mm} \\ &= 5.47 \times 10^7\; \rm{mm} \end{align} \nonumber \]
En cada paso, se cancela la unidad anterior y se produce la siguiente unidad en la secuencia; cada unidad sucesiva se cancela, hasta que solo queda la unidad necesaria en la respuesta.
Convierta 58.2 ms en megaseconds en un cálculo de varios pasos.
Solución
Pasos para la resolución de problemas |
Conversión de unidades |
|---|---|
| Identifica la información “dada” y cuál es el problema que te pide “encontrar”. |
Dado: 58.2 ms Buscar: Ms |
| Enumere otras cantidades conocidas. |
\(1 ms = 10^{-3} s \) \(1 Ms = 10^6s \) |
| Preparar un mapa conceptual. |
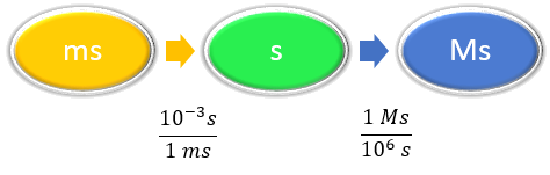
|
| Calcular. |
\[ \begin{align} 58.2 \; \cancel{\rm{ms}} \times \dfrac{10^{-3} \cancel{\rm{s}}}{1\; \cancel{\rm{ms}}} \times \dfrac{1\; \rm{Ms}}{1,000,000\; \cancel{ \rm{s}}} & =0.0000000582\; \rm{Ms} \nonumber\\ &= 5.82 \times 10^{-8}\; \rm{Ms}\nonumber \end{align}\nonumber \] Ninguno de los factores de conversión afecta el número de cifras significativas en la respuesta final. |
¿Cuántos segundos hay en un día?
Solución
Pasos para la resolución de problemas |
Conversión de unidades |
|---|---|
| Identifica la información “dada” y cuál es el problema que te pide “encontrar”. |
Dado: 1 día Buscar: s |
| Enumere otras cantidades conocidas. |
1 día = 24 horas 1 hora = 60 minutos 1 minuto = 60 segundos |
| Preparar un mapa conceptual. |
|
| Calcular. | \[1 \: \text{d} \times \frac{24 \: \text{hr}}{1 \: \text{d}}\times \frac{60 \: \text{min}}{1 \: \text{hr}} \times \frac{60 \: \text{s}}{1 \: \text{min}} = 86,400 \: \text{s} \nonumber \] |
Realice cada conversión en un cálculo de varios pasos.
- 43.007 ng a kg
- 1005 in a ft
- 12 mi a km
- Respuesta a:
- \(4.3007 x 10^{-14} kg \)
- Respuesta b:
- 83.75 pies
- Respuesta c:
- 19 km
Resumen
- Los prefijos métricos derivan de términos latinos o griegos. Los prefijos se utilizan para hacer que las unidades sean manejables.
- El sistema SI se basa en múltiplos de diez. Hay siete unidades básicas en el sistema SI. Cinco de estas unidades se utilizan comúnmente en química.
- La masa es una medida de la cantidad de materia que contiene un objeto.
- El peso es una medida de fuerza que es igual a la atracción gravitacional sobre un objeto.
- La masa es independiente de la ubicación, mientras que el peso depende de la ubicación.
- La longitud es la medida de la extensión de algo a lo largo de su mayor dimensión.
- Volumen es la cantidad de espacio ocupado por una muestra de materia.
- El volumen se puede determinar conociendo la longitud de cada lado del artículo.
- Los factores de conversión se utilizan para convertir una unidad de medida en otra.
- El análisis dimensional (conversiones de unidades) implica el uso de factores de conversión que cancelarán las unidades no deseadas y producirán unidades deseadas.
Colaboradores y Atribuciones
CK-12 Foundation by Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson, and Jean Dupon.
Henry Agnew (UC Davis)
- Hayden Cox (Furman University)

