2.5: Mendeleev y Tabla Periódica
- Page ID
- 72600
- Explicar cómo se organizan los elementos en la tabla periódica.
- Describir cómo algunas características de los elementos se relacionan con sus posiciones en la tabla periódica.
La Tabla Periódica es el símbolo de la Química para muchos. Se trata de una sola imagen que contiene todos los elementos conocidos del universo combinados en una tabla fácilmente legible. También hay muchos patrones presentes en la tabla. Todos los elementos parecen encajar, conectándose para formar la “imagen de la química”. La idea de los elementos surgió por primera vez en 3000 a.C El gran filósofo griego Aristóteles concibió la idea de que todo en la tierra estaba conformado por estos elementos. En la antigüedad, elementos como el oro y la plata eran fácilmente accesibles, sin embargo, los elementos que Aristóteles eligió fueron la Tierra, el Agua, el Fuego y el Aire.
Patrones emergentes y periodicidad dentro de los elementos conocidos
La tabla periódica moderna ha evolucionado a través de una larga historia de intentos por parte de los químicos de organizar los elementos de acuerdo a sus propiedades, como una ayuda para predecir el comportamiento químico. Uno de los primeros en sugerir tal arreglo fue el químico alemán Johannes Dobereiner (1780—1849), quien notó que muchos de los elementos conocidos podían agruparse en tríadas. Una tríada es un conjunto de tres elementos que tienen propiedades similares, por ejemplo, cloro, bromo y yodo; cobre, plata y oro. Dobereiner propuso que todos los elementos pudieran agruparse en tales tríadas, pero los intentos posteriores de ampliar su concepto no tuvieron éxito.
A mediados del siglo XIX se habían determinado las masas atómicas de muchos de los elementos. Científicos como John Newlands y Alexandre-Emile Béguyer de Chancourtois formaron sus propias versiones de tablas periódicas. El químico inglés John Newlands (1838—1898), quien planteó la hipótesis de que la química de los elementos podría estar relacionada con sus masas, dispuso los elementos conocidos en orden de aumentar la masa atómica y descubrió que cada séptimo elemento tenía propiedades similares. Por lo tanto, Newlands sugirió que los elementos podrían clasificarse en octavas. Describió a las octavas como un grupo de siete elementos, que corresponden a las filas horizontales en los grupos principales de la tabla periódica de hoy. Había siete elementos, debido a que en su momento no se conocían los gases nobles. Desafortunadamente, la “ley de octavas” de Newlands no parecía funcionar para elementos más pesados que el calcio, y su idea fue ridiculizada públicamente.
La Tabla Periódica: Mendeleev y Meyer
La tabla periódica logró su forma moderna a través de la obra del químico alemán Julius Lothar Meyer (1830—1895) y del químico ruso Dimitri Mendeleev (1834—1907), ambos enfocados en las relaciones entre la masa atómica y diversas propiedades físicas y químicas. En 1869, propusieron independientemente arreglos esencialmente idénticos de los elementos. Meyer alineó los elementos de su tabla según variaciones periódicas en las propiedades atómicas simples, como el “volumen atómico”, que obtuvo dividiendo la masa atómica (masa molar) en gramos por mol por la densidad del elemento en gramos por centímetro cúbico. Esta propiedad equivale a lo que hoy se define como el volumen molar, la masa molar de un elemento dividido por su densidad (medida en centímetros cúbicos por mol):
\[ \frac{molar\; mass\left ( \cancel{g}/mol \right )}{density\left ( \cancel{g}/cm^{3} \right )}=molar\; volume\left ( cm^{3}/mol \right ) \tag{3.1.1} \]
Mendeleev, quien publicó por primera vez su tabla periódica en 1869 (Figura\(\PageIndex{1}\)), generalmente se le atribuye el origen de la tabla periódica moderna. La diferencia clave entre su disposición de los elementos, y la de Meyer y otros, es que Mendeleev no asumió que todos los elementos habían sido descubiertos (de hecho, solo alrededor de dos tercios de los elementos naturales se conocían en ese momento). En cambio, deliberadamente dejó espacios en blanco en su mesa a las masas atómicas 44, 68, 72 y 100, con la expectativa de que se descubrieran elementos con esas masas atómicas. Esos espacios en blanco corresponden a los elementos que hoy conocemos como escandio, galio, germanio y tecnecio.
Los grupos en la tabla de Mendeleev están determinados por cuántos átomos de oxígeno o hidrógeno se necesitan para formar compuestos con cada elemento. Por ejemplo, en el Grupo I, dos átomos de hidrógeno (H), litio (Li), sodio (Na) y potasio (K) forman compuestos con un átomo de oxígeno. En el Grupo VII, un átomo de flúor (F), cloro (Cl) y bromo (Br), reaccionan con un átomo de hidrógeno. Observe cómo este enfoque tiene problemas con los metales de transición. Hasta aproximadamente 1960, una mesa rectangular basada en la reactividad, desarrollada a partir de la mesa de Mendeleev, era estándar en la parte delantera de las salas de conferencias de química.
La evidencia más convincente en apoyo de la disposición de Mendeleev de los elementos fue el descubrimiento de dos elementos previamente desconocidos cuyas propiedades correspondían estrechamente con sus predicciones (Tabla\(\PageIndex{1}\)). Dos de los espacios en blanco que Mendeleev había dejado en su mesa original estaban debajo del aluminio y el silicio, esperando el descubrimiento de dos elementos aún desconocidos, eka -aluminio y eka -silicio (del sánscrito eka, que significa “uno”, como en “uno más allá del aluminio”). Las propiedades observadas del galio y germanio coincidieron con las del eka -aluminio y ekasilicio tan bien que una vez descubiertas, la tabla periódica de Mendeleev rápidamente ganó aceptación.
Video\(\PageIndex{1}\): El genio de la tabla periódica de Mendeleev.
| Inmueble | eka -Aluminio (predicho) | Galio (observado) | eka -Silicio (predicho) | Germanio (observado) |
|---|---|---|---|---|
| masa atómica | 68 | 69.723 | 72 | 72.64 |
| elemento | metal | metal | metal gris sucio | Gris-Blanco Metal |
| bajo mp* | mp = 29.8°C | alto mp | mp = 938°C | |
| d = 5.9 g/cm 3 | d = 5.91 g/cm 3 | d = 5.5 g/cm 3 | d = 5.323 g/cm 3 | |
| óxido | E 2 O 3 | Ga 2 O 3 | EO 2 | GeO 2 |
| d = 5.5 g/cm 3 | d = 6.0 g/cm 3 | d = 4.7 g/cm 3 | d = 4.25 g/cm 3 | |
| cloruro | ECl 3 | GACL 3 | ECl 4 | GECL 4 |
| volátil |
mp = 78°C bp* = 201°C |
bp < 100°C | bp = 87°C | |
| *mp = punto de fusión; bp = punto de ebullición. | ||||
Cuando las propiedades químicas de un elemento sugerían que podría haber sido asignado el lugar equivocado en tablas anteriores, Mendeleev reexaminó cuidadosamente su masa atómica. Descubrió, por ejemplo, que las masas atómicas reportadas anteriormente para berilio, indio y uranio eran incorrectas. La masa atómica del indio había sido reportada originalmente como 75.6, basada en una supuesta estequiometría de iNO para su óxido. Si esta masa atómica fuera correcta, entonces el indio tendría que colocarse en el medio de los no metales, entre el arsénico (masa atómica 75) y el selenio (masa atómica 78). Debido a que el indio elemental es un metal blanco plateado, sin embargo, Mendeleev postuló que la estequiometría de su óxido estaba realmente en 2 O 3 en lugar de iNO. Esto significaría que la masa atómica del indio era en realidad 113, colocando el elemento entre otros dos metales, el cadmio y el estaño.
Un grupo de elementos que estuvo ausente de la mesa de Mendeleev son los gases nobles, todos los cuales fueron descubiertos más de 20 años después —entre 1894 y 1898— por Sir William Ramsay (1852—1916; Premio Nobel de Química 1904). Inicialmente, Ramsay no sabía dónde colocar estos elementos en la tabla periódica. El argón, el primero en ser descubierto, tenía una masa atómica de 40. Esto era mayor que el cloro y comparable al del potasio; por lo que Ramsay, usando el mismo tipo de razonamiento que Mendeleev, decidió colocar los gases nobles entre los halógenos y los metales alcalinos. En 1913, sin embargo, el joven físico británico H. G. J. Moseley (1887—1915) analizó las frecuencias de los rayos X emitidos por los elementos, y descubrió que la base subyacente del orden de los elementos era por el número atómico —no la masa atómica—. Moseley planteó la hipótesis de que la colocación de cada elemento en su serie correspondía a su número atómico Z, que es el número de cargas positivas (protones) en su núcleo. Moseley dejó su trabajo de investigación en la Universidad de Oxford para unirse al ejército británico como oficial de telecomunicaciones durante la Primera Guerra Mundial Murió durante la Batalla de Gallipoli en Turquía. Finalmente, en 1945, el Proyecto Manhattan arrojó el descubrimiento de muchos nuevos elementos radiactivos. Glenn T. Seaborg sugirió una adición de las series de actínidos y lantánidos en la parte inferior de la tabla. Esta idea vino con el descubrimiento de Americium y Curio, y sus propiedades únicas. El cambio no fue aceptado al principio, pero ahora está incluido en todas las tablas periódicas. La figura \(\PageIndex{2}\)muestra el periodo de tiempo para el descubrimiento de los diferentes elementos.
- Antes de 1800 (36 elementos): Descubrimientos durante y antes de la Era de la Ilustración.
- 1800-1849 (+22 elementos): Impulso desde la Revolución Científica y la Teoría Atómica y la Revolución Industrial.
- 1850-1899 (+23 elementos): La era de los Elementos Clasificadores recibió un impulso del análisis del Espectro.
- 1900-1949 (+13 elementos): Impulso desde la antigua teoría cuántica, los Refinamientos a la tabla periódica y la mecánica cuántica.
- 1950-1999 (+15 elementos): Proyecto Manhattan y temas de Física de partículas, para los números atómicos 97 y superiores.
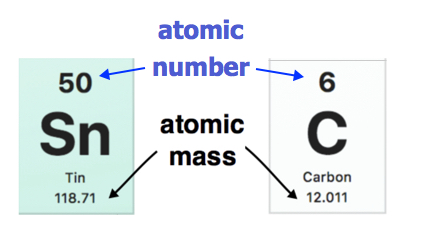
Cada elemento de la tabla periódica moderna está representado por su número atómico y masa atómica (Figura \(\PageIndex{3}\)). La masa atómica de cada elemento se encuentra bajo el símbolo del elemento en la tabla periódica. A continuación se muestran ejemplos. La masa atómica del estaño (Sn) es 118.71 u mientras que la masa atómica del carbono (C) es 12.011 u. Por otra parte, el número atómico (Z) de cada elemento se encuentra por encima del símbolo atómico.
La tabla periódica se encuentra en este enlace:
Resumen
- La tabla periódica moderna se basó en correlaciones empíricas de propiedades como la masa atómica; los primeros modelos que utilizaron datos limitados señalaron la existencia de tríadas y octavas de elementos con propiedades similares.
- La tabla periódica logró su forma actual a través del trabajo de Dimitri Mendeleev y Julius Lothar Meyer, ambos enfocados en la relación entre la masa atómica y las propiedades químicas.
- La correlación con la estructura electrónica de los átomos se descubrió cuando H. G. J. Moseley demostró que la disposición periódica de los elementos estaba determinada por el número atómico, no por la masa atómica.
Colaboradores y Atribuciones
- Anonymous
Modified by Joshua Halpern (Howard University)
- Genius of Mendelev by TED Ed on YouTube
Ed Vitz (Kutztown University), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (University of Minnesota Rochester), Tim Wendorff, and Adam Hahn.


