3.5: El Núcleo Atómico
- Page ID
- 72244
- Enumere las propiedades de las tres partículas subatómicas principales.
- Definir unidad de masa atómica (amu).
- Definir número atómico y número de masa.
- Definir isótopos.
- Determinar el número de protones, neutrones y electrones en un átomo con un número de masa dado.
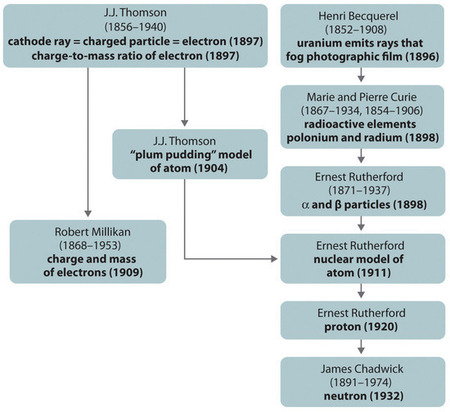
Figura\(\PageIndex{1}\) Un resumen del desarrollo histórico de modelos de los componentes y estructura del átomo. Las fechas entre paréntesis son los años en que se realizaron los experimentos clave. (CC BY-SA-NC).
 El modelo del átomo de Rutherford es esencialmente el mismo que el modelo moderno, excepto que ahora se sabe que los electrones no están distribuidos uniformemente a lo largo del volumen de un átomo. En cambio, se distribuyen de acuerdo con un conjunto de principios descritos por la Mecánica Cuántica. Figura\(\PageIndex{2}\) shows how the model of the atom has evolved over time from the indivisible unit of Dalton to the modern view taught today.
El modelo del átomo de Rutherford es esencialmente el mismo que el modelo moderno, excepto que ahora se sabe que los electrones no están distribuidos uniformemente a lo largo del volumen de un átomo. En cambio, se distribuyen de acuerdo con un conjunto de principios descritos por la Mecánica Cuántica. Figura\(\PageIndex{2}\) shows how the model of the atom has evolved over time from the indivisible unit of Dalton to the modern view taught today.Figura\(\PageIndex{2}\) La evolución de la teoría atómica, ilustrada por modelos del átomo de oxígeno. El modelo de Bohr y el modelo actual se describen en el Capítulo 6, “La estructura de los átomos”. Imagen utilizada con Permiso (CC BY-SA-NC).
El núcleo (plural, núcleos) es una región cargada positivamente en el centro del átomo. Consiste en dos tipos de partículas subatómicas empaquetadas firmemente juntas. Las partículas son protones, que tienen una carga eléctrica positiva, y neutrones, que son neutros en carga eléctrica. Fuera del núcleo, un átomo es principalmente espacio vacío, con partículas negativas orbitantes llamadas electrones zumbando a través de él. La \(\PageIndex{3}\)siguiente figura muestra estas partes del átomo.
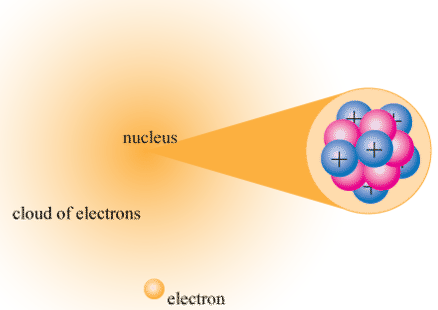
El núcleo del átomo es extremadamente pequeño. Su radio es solo alrededor de 1/100,000 del radio total del átomo. Si un átomo fuera del tamaño de un estadio de fútbol, ¡el núcleo sería aproximadamente del tamaño de un guisante! Los electrones prácticamente no tienen masa, pero los protones y neutrones tienen mucha masa para su tamaño. Como resultado, el núcleo tiene prácticamente toda la masa de un átomo. Dada su gran masa y su pequeño tamaño, el núcleo es muy denso. Si un objeto del tamaño de un centavo tuviera la misma densidad que el núcleo de un átomo, ¡su masa sería superior a 30 millones de toneladas!
Las partículas con cargas eléctricas opuestas se atraen entre sí. Esto explica por qué los electrones negativos orbitan el núcleo positivo. Las partículas con la misma carga eléctrica se repelen entre sí. Esto quiere decir que los protones positivos en el núcleo se alejan unos de otros. Entonces, ¿por qué el núcleo no vuela aparte? Una fuerza aún más fuerte -llamada la fuerza nuclear fuerte - mantiene juntos protones y neutrones en el núcleo.
| Partícula | Símbolo | Masa (amu) | Masa relativa (protón = 1) | Carga Relativa | Ubicación |
|---|---|---|---|---|---|
| protón | p + | 1 | 1 | +1 | dentro del núcleo |
| electrón | e − | 5.45× 10 −4 | 0.00055 | −1 | núcleo exterior |
| neutrones | n 0 | 1 | 1 | 0 | dentro del núcleo |
1 amu = 1.6605 × 10 −24 g = 1.6605 × 10-27 kg
Número atómico
Las cargas negativas y positivas de igual magnitud se cancelan entre sí. Esto significa que la carga negativa sobre un electrón equilibra perfectamente la carga positiva sobre el protón. Es decir, un átomo neutro debe tener exactamente un electrón por cada protón. Si un átomo neutro tiene 1 protón, debe tener 1 electrón. Si un átomo neutro tiene 2 protones, debe tener 2 electrones. Si un átomo neutro tiene 10 protones, debe tener 10 electrones. Se te da la idea. Para ser neutro, un átomo debe tener el mismo número de electrones y protones.
Los científicos distinguen entre diferentes elementos contando el número de protones en el núcleo (Tabla\(\PageIndex{2}\)). Si un átomo solo tiene un protón, sabemos que es un átomo de hidrógeno. Un átomo con dos protones es siempre un átomo de helio. Si los científicos cuentan cuatro protones en un átomo, saben que es un átomo de berilio. Un átomo con tres protones es un átomo de litio, un átomo con cinco protones es un átomo de boro, un átomo con seis protones es un átomo de carbono.. la lista continúa.
Dado que un átomo de un elemento puede distinguirse de un átomo de otro elemento por el número de protones en su núcleo, los científicos siempre están interesados en este número, y cómo este número difiere entre diferentes elementos. El número de protones en un átomo se llama su número atómico (\(Z\)). Este número es muy importante porque es único para los átomos de un elemento dado. Todos los átomos de un elemento tienen el mismo número de protones, y cada elemento tiene un número diferente de protones en sus átomos. Por ejemplo, todos los átomos de helio tienen dos protones, y ningún otro elemento tiene átomos con dos protones.
| Nombre | Protones | Neutrones | Electrones | Número atómico (Z) | Número de masa (A) |
|---|---|---|---|---|---|
| Hidrógeno | 1 | 0 | 1 | 1 | 1 |
| Helio | 2 | 2 | 2 | 2 | 4 |
| Litio | 3 | 4 | 3 | 3 | 7 |
| Berilio | 4 | 5 | 4 | 4 | 9 |
| Boro | 5 | 6 | 5 | 5 | 11 |
| Carbono | 6 | 6 | 6 | 6 | 12 |
Por supuesto, dado que los átomos neutros tienen que tener un electrón por cada protón, el número atómico de un elemento también te dice cuántos electrones hay en un átomo neutro de ese elemento. Por ejemplo, el hidrógeno tiene un número atómico de 1. Esto significa que un átomo de hidrógeno tiene un protón, y, si es neutro, un electrón también. El oro, en cambio, tiene un número atómico de 79, lo que significa que un átomo de oro tiene 79 protones, y, si es neutro, 79 electrones también.
Los átomos son neutros en la carga eléctrica porque tienen el mismo número de electrones negativos que los protones positivos (Tabla\(\PageIndex{2}\)). Por lo tanto, el número atómico de un átomo también te dice cuántos electrones tiene el átomo. Esto, a su vez, determina muchas de las propiedades químicas del átomo.
Número Masivo
El número de masa (\(A\)) de un átomo es el número total de protones y neutrones en su núcleo. La masa del átomo es una unidad llamada unidad de masa atómica\(\left( \text{amu} \right)\). Una unidad de masa atómica es la masa de un protón, o aproximadamente\(1.67 \times 10^{-27}\) kilogramos, que es una masa extremadamente pequeña. Un neutrón tiene apenas un poquito más masa que un protón, pero a menudo se supone que su masa es una unidad de masa atómica también. Debido a que los electrones prácticamente no tienen masa, casi toda la masa de un átomo está en sus protones y neutrones. Por lo tanto, el número total de protones y neutrones en un átomo determina su masa en unidades de masa atómica (Tabla\(\PageIndex{2}\)).
Considera de nuevo el helio. La mayoría de los átomos de helio tienen dos neutrones además de dos protones. Por lo tanto, la masa de la mayoría de los átomos de helio es de 4 unidades de masa atómica (\(2 \: \text{amu}\)para los protones +\(2 \: \text{amu}\) para los neutrones). Sin embargo, algunos átomos de helio tienen más o menos de dos neutrones. Los átomos con el mismo número de protones pero diferentes números de neutrones se denominan isótopos. Debido a que el número de neutrones puede variar para un elemento dado, los números de masa de diferentes átomos de un elemento también pueden variar. Por ejemplo, algunos átomos de helio tienen tres neutrones en lugar de dos (estos se llaman isótopos y se discuten en detalle más adelante)
¿Por qué cree que el “número de masa” incluye protones y neutrones, pero no electrones? Sabes que la mayor parte de la masa de un átomo se concentra en su núcleo. La masa de un átomo depende del número de protones y neutrones. Ya aprendiste que la masa de un electrón es muy, muy pequeña en comparación con la masa de ya sea un protón o un neutrón (como la masa de un centavo en comparación con la masa de una bola de boliche). Contar el número de protones y neutrones habla a los científicos sobre la masa total de un átomo. El número de masa de un átomo es muy fácil de calcular siempre que se conozca el número de protones y neutrones en un átomo. El número de masa de un átomo de carbono con 6 protones y 7 neutrones se calcula y se muestra de la siguiente manera:
\[\text{mass number} \: A = \left( \text{number of protons} \right) + \left( \text{number of neutrons} \right) \nonumber \]
\[\text{mass number} = \text{6} + \text{6} = \text{12} \nonumber \]

¿Cuál es el número de masa de un átomo de helio que contiene 2 neutrones?
Solución
\(\left( \text{number of protons} \right) = 2\)(Recuerda que un átomo de helio siempre tiene 2 protones.)
\(\left( \text{number of neutrons} \right) = 2\)
\(\text{mass number} = \left( \text{number of protons} \right) + \left( \text{number of neutrons} \right)\)
\(\text{mass number} = 2 + 2 = 4\)
Isótopos
Todos los átomos del mismo elemento tienen el mismo número de protones, pero algunos pueden tener diferentes números de neutrones. Por ejemplo, todos los átomos de carbono tienen seis protones, y la mayoría también tienen seis neutrones. Pero algunos átomos de carbono tienen siete u ocho neutrones en lugar de los seis habituales. Los átomos del mismo elemento que difieren en su número de neutrones se denominan isótopos. Muchos isótopos ocurren de forma natural. Por lo general, uno o dos isótopos de un elemento son los más estables y comunes. Diferentes isótopos de un elemento generalmente tienen las mismas propiedades físicas y químicas. Eso es porque tienen el mismo número de protones y electrones.
Un ejemplo: Isótopos de hidrógeno
El hidrógeno es un ejemplo de un elemento que tiene isótopos. Tres isótopos de hidrógeno se modelan en la Figura\(\PageIndex{4}\). La mayoría de los átomos de hidrógeno tienen solo un protón y un electrón y carecen de neutrones. Estos átomos se llaman simplemente hidrógeno. Algunos átomos de hidrógeno también tienen un neutrón. Estos átomos son el isótopo llamado deuterio. Otros átomos de hidrógeno tienen dos neutrones. Estos átomos son el isótopo llamado tritio.

Para la mayoría de los elementos distintos del hidrógeno, los isótopos se nombran por su número de masa. Por ejemplo, los átomos de carbono con los 6 neutrones habituales tienen un número de masa de 12 (6 protones + 6 neutrones = 12), por lo que se denominan carbono-12. Los átomos de carbono con 7 neutrones tienen una masa atómica de 13 (6 protones + 7 neutrones = 13). Estos átomos son el isótopo llamado carbono-13.
- Cuál es el número atómico y el número másico de un isótopo de litio que contiene 3 neutrones.
- ¿Cuál es el número atómico y el número de masa de un isótopo de litio que contiene 4 neutrones?
Solución
Un átomo de litio contiene 3 protones en su núcleo independientemente del número de neutrones o electrones.
a.
\[ \begin{align}\text{atomic number} = \left( \text{number of protons} \right) &= 3 \nonumber \\ \left( \text{number of neutrons} \right) &= 3 \nonumber\end{align} \nonumber \]
\[ \begin{align} \text{mass number} & = \left( \text{number of protons} \right) + \left( \text{number of neutrons} \right) \nonumber\\ \text{mass number} & = 3 + 3 \nonumber\\ &= 6 \nonumber \end{align}\nonumber \]
b.
\[ \begin{align}\text{atomic number} = \left( \text{number of protons} \right) &= 3 \nonumber\\ \left( \text{number of neutrons} \right) & = 4\nonumber\end{align}\nonumber \]
\[ \begin{align}\text{mass number} & = \left( \text{number of protons} \right) + \left( \text{number of neutrons} \right)\nonumber \\ \text{mass number} & = 3 + 4\nonumber \\ &= 7 \nonumber \end{align}\nonumber \]
Observe que debido a que el átomo de litio siempre tiene 3 protones, el número atómico para el litio es siempre 3. El número de masa, sin embargo, es 6 en el isótopo con 3 neutrones y 7 en el isótopo con 4 neutrones. En la naturaleza, solo existen ciertos isótopos. Por ejemplo, el litio existe como un isótopo con 3 neutrones, y como un isótopo con 4 neutrones, pero no existe como un isótopo con 2 neutrones o como un isótopo con 5 neutrones.
El número de protones en el núcleo de un átomo de estaño es de 50, mientras que el número de neutrones en el núcleo es de 68. ¿Cuáles son el número atómico y el número de masa de este isótopo?
- Contestar
-
Número atómico = 50, número de masa = 118
Símbolos para isótopos
Hay dos formas principales en las que los científicos muestran frecuentemente el número de masa de un átomo que les interesa. Es importante señalar que el número masivo no se da en la tabla periódica. Estas dos formas incluyen escribir un símbolo nuclear o dar el nombre del elemento con el número masivo escrito.
Para escribir un símbolo nuclear, el número de masa se coloca en la parte superior izquierda (superíndice) del símbolo químico y el número atómico se coloca en la parte inferior izquierda (subíndice) del símbolo. El símbolo nuclear completo para helio-4 se dibuja a continuación:

Los siguientes símbolos nucleares son para un núcleo de níquel con 31 neutrones y un núcleo de uranio con 146 neutrones.
\[\ce{^{59}_{28}Ni} \nonumber \]
\[ \ce{ ^{238}_{92}U} \nonumber \]
En el núcleo de níquel representado anteriormente, el número atómico 28 indica que el núcleo contiene 28 protones, y por lo tanto, debe contener 31 neutrones para tener un número de masa de 59. El núcleo de uranio tiene 92 protones al igual que todos los núcleos de uranio y este núcleo de uranio en particular tiene 146 neutrones.
Otra forma de representar isótopos es agregando un guión y el número de masa al nombre o símbolo químico. Así los dos núcleos serían Níquel-59 o Ni-59 y Uranio-238 o U-238, donde 59 y 238 son los números de masa de los dos átomos, respectivamente. Tenga en cuenta que los números de masa (no el número de neutrones) se dan al lado del nombre.
¿Cuántos protones, electrones y neutrones hay en un átomo de\(^{40}_{19}\ce{K}\)?
Solución
\[\text{atomic number} = \left( \text{number of protons} \right) = 19 \nonumber \]
Para todos los átomos sin carga, el número de electrones es igual al número de protones.
\[\text{number of electrons} = 19 \nonumber \]
El número de masa, 40 es la suma de los protones y los neutrones.
Para encontrar el número de neutrones, restar el número de protones del número de masa.
\[\text{number of neutrons} = 40 - 19 = 21. \nonumber \]
¿Cuántos protones, electrones y neutrones hay en un átomo de zinc-65?
Solución
\[\text{number of protons} = 30 \nonumber \]
Para todos los átomos sin carga, el número de electrones es igual al número de protones.
\[\text{number of electrons} = 30 \nonumber \]
El número de masa, 65 es la suma de los protones y los neutrones.
Para encontrar el número de neutrones, restar el número de protones del número de masa.
\[\text{number of neutrons} = 65 - 30 = 35 \nonumber \]
¿Cuántos protones, electrones y neutrones hay en cada átomo?
- \(^{60}_{27}\ce{Co}\)
- Na-24
- \(^{45}_{20}\ce{Ca}\)
- Sr-90
- Respuesta a:
- 27 protones, 27 electrones, 33 neutrones
- Respuesta b:
- 11 protones, 11 electrones, 13 neutrones
- Respuesta c:
- 20 protones, 20 electrones, 25 neutrones
- Respuesta d:
- 38 protones, 38 electrones, 52 neutrones
| Element | Símbolo | Número atómico | Número de protones | Número de Neutrones | Masa (amu) | % Abundancia Natural |
|---|---|---|---|---|---|---|
| hidrógeno | \(\ce{^1_1H}\) (protio) |
1 | 1 | 0 | 1.0078 | 99.989 |
| \(\ce{^2_1H}\) (deuterio) |
1 | 1 | 1 | 2.0141 | 0.0115 | |
| \(\ce{^3_1H}\) (tritio) |
1 | 1 | 2 | 3.01605 | — (traza) | |
| helio | \(\ce{^3_2He}\) | 2 | 2 | 1 | 3.01603 | 0.00013 |
| \(\ce{^4_2He}\) | 2 | 2 | 2 | 4.0026 | 100 | |
| litio | \(\ce{^6_3Li}\) | 3 | 3 | 3 | 6.0151 | 7.59 |
| \(\ce{^7_3Li}\) | 3 | 3 | 4 | 7.0160 | 92.41 | |
| berilio | \(\ce{^9_4Be}\) | 4 | 4 | 5 | 9.0122 | 100 |
| boro | \(\ce{^{10}_5B}\) | 5 | 5 | 5 | 10.0129 | 19.9 |
| \(\ce{^{11}_5B}\) | 5 | 5 | 6 | 11.0093 | 80.1 | |
| carbono | \(\ce{^{12}_6C}\) | 6 | 6 | 6 | 12.0000 | 98.89 |
| \(\ce{^{13}_6C}\) | 6 | 6 | 7 | 13.0034 | 1.11 | |
| \(\ce{^{14}_6C}\) | 6 | 6 | 8 | 14.0032 | — (traza) |
Resumen
- El átomo consiste en partículas discretas que gobiernan su comportamiento químico y físico.
- Cada átomo de un elemento contiene el mismo número de protones, que es el número atómico (Z).
- Los átomos neutros tienen el mismo número de electrones y protones.
- Los átomos de un elemento que contienen diferentes números de neutrones se denominan isótopos.
- Cada isótopo de un elemento dado tiene el mismo número atómico pero un número másico diferente (A), que es la suma de los números de protones y neutrones.
- Las masas relativas de los átomos se reportan usando la unidad de masa atómica (amu) que se define como una doceava parte de la masa de un átomo de carbono-12, con 6 protones, 6 neutrones y 6 electrones. El modelo nuclear del átomo consiste en un interior pequeño y denso cargado positivamente rodeado por una nube de electrones.
Colaboradores y Atribuciones
CK-12 Foundation by Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson, and Jean Dupon.
Paul Flowers (University of North Carolina - Pembroke), Klaus Theopold (University of Delaware) and Richard Langley (Stephen F. Austin State University) with contributing authors. Textbook content produced by OpenStax College is licensed under a Creative Commons Attribution License 4.0 license. Download for free at http://cnx.org/contents/85abf193-2bd...a7ac8df6@9.110).
- TextMap: Chemistry-The Central Science (Brown et al.)
- TextMap: Fundamentals of General, Organicn, and Biological Chemistry (McMurry et al.)
Henry Agnew (UC Davis)


\[\begin{alignat*}{3} &[x \mapsto s]x &&= s && \\ &[x \mapsto s]y &&= y \qquad &&\text{als } y\neq x \\ &[x \mapsto s](\lambda(y)t_1) &&= \lambda(y)[x \mapsto s]t_1 \qquad &&\text{als } y \neq x \text{ en } y \not \in FV(s) \\ &[x \mapsto s](t_1 \; t_2)&&= ([x \mapsto s]t_1)\;([x \mapsto s]t_2) && \end{alignat*} \nonumber \]