3.6: Arreglo de Electrones- El Modelo Bohr (Órbitas)
- Page ID
- 72234
- Conocer las propiedades de diferentes tipos de radiación electromagnética.
- Definir un nivel de energía en términos del modelo Bohr.
- Discutir cómo se puede utilizar el modelo de Bohr para explicar los espectros atómicos.
- Describir la disposición de los electrones usando el modelo de shell.
Las ondas electromagnéticas tienen un rango extremadamente amplio de longitudes de onda, frecuencias y energías. La forma de energía más alta de las ondas electromagnéticas son los rayos gamma (γ) y la forma de energía más baja son las ondas de radio.
La siguiente figura muestra el espectro electromagnético, que es todas las formas de radiación electromagnética. En el extremo izquierdo de la Figura\(\PageIndex{1}\) se encuentran las ondas electromagnéticas de mayor energía. Estos se llaman rayos gamma y pueden ser bastante peligrosos, en grandes cantidades, para los sistemas vivos. La siguiente forma de energía más baja de las ondas electromagnéticas se llaman rayos X. La mayoría de ustedes están familiarizados con las habilidades de penetración de estas ondas. También pueden ser peligrosos para los sistemas vivos. Se aconseja a los humanos que limiten lo posible el número de radiografías médicas que tienen por año. Siguiente más abajo, en energía, son los rayos ultravioleta. Estos rayos forman parte de la luz solar y el extremo superior del rango ultravioleta puede provocar quemaduras solares y quizás cáncer de piel. La pequeña sección siguiente en el espectro es el rango visible de luz... esta sección se ha ampliado mucho en la mitad inferior de la figura por lo que se puede discutir con más detalle. El rango visible de radiación electromagnética son las frecuencias a las que responde el ojo humano. Más bajo en el espectro son los rayos infrarrojos y las ondas de radio.
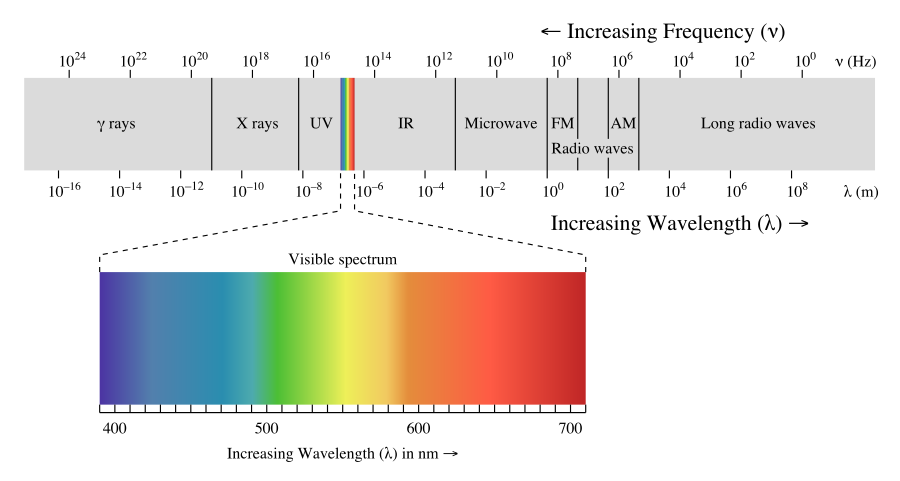
Las energías de luz que están en el rango visible son ondas electromagnéticas que hacen que el ojo humano responda cuando esas frecuencias ingresan al ojo. El ojo envía una señal al cerebro y el individuo “ve” varios colores. Las ondas de energía más altas en la región visible hacen que el cerebro vea violeta y a medida que la energía disminuye, los colores cambian a azul, verde, amarillo, naranja y rojo. Cuando la energía de la onda está por encima o por debajo del rango visible, el ojo no responde a ellos. Cuando el ojo recibe varias frecuencias diferentes al mismo tiempo, los colores son mezclados por el cerebro. Si todas las frecuencias de luz golpean el ojo juntas, el cerebro ve blanco y si no hay frecuencias visibles golpeando el ojo, el cerebro ve negro. Los objetos que ves a tu alrededor son absorbedores de luz, es decir, los químicos en la superficie del objeto absorberán ciertas frecuencias y no otras. Tus ojos detectan las frecuencias que golpean tu ojo. Por lo tanto, si tu amigo lleva una camisa roja, significa que el tinte en esa camisa absorbe todas las frecuencias excepto el rojo y las frecuencias rojas se reflejan. Si tu única fuente de luz era una frecuencia exacta de luz azul y la brillabas en una camisa que era roja a la luz del sol, la camisa aparecería negra porque ninguna luz se reflejaría. La luz de los tipos de luces fluorescentes no contienen todas las frecuencias de luz solar y por lo tanto, la ropa dentro de una tienda puede parecer de un color ligeramente diferente al de cuando la llevas a casa.
Espectros continuos y de línea
Las bombillas eléctricas contienen un cable muy delgado en ellas que emite luz cuando se calientan. El alambre se llama filamento. El alambre particular utilizado en las bombillas está hecho de tungsteno. Un alambre hecho de cualquier metal emitiría luz bajo estas circunstancias pero se eligió tungsteno porque la luz que emite contiene prácticamente todas las frecuencias y por lo tanto, la luz emitida por el tungsteno aparece blanca. Un alambre hecho de algún otro elemento emitiría luz de algún color que no era conveniente para nuestros usos. Cada elemento emite luz cuando se energiza calentando o pasando corriente eléctrica a través de él. Los elementos en forma sólida comienzan a brillar cuando se calientan suficientemente y los elementos en forma gaseosa emiten luz cuando la electricidad pasa a través de ellos. Esta es la fuente de luz emitida por los letreros de neón y también es la fuente de luz en un incendio.

Cada elemento tiene un espectro único
Las frecuencias de luz emitidas por los átomos son mezcladas por nuestros ojos para que veamos un color mezclado. Varios físicos, entre ellos Angstrom en 1868 y Balmer en 1875, pasaron la luz de átomos energizados a través de prismas de vidrio de tal manera que la luz se extendió para que pudieran ver las frecuencias individuales que componían la luz. El espectro de emisión (o espectro atómico) de un elemento químico es el patrón único de luz que se obtiene cuando el elemento es sometido a calor o electricidad.

Cuando se coloca gas hidrógeno en un tubo y la corriente eléctrica pasa a través de él, el color de la luz emitida es el rosa. Pero cuando el color se extiende, vemos que el espectro de hidrógeno está compuesto por cuatro frecuencias individuales. El color rosa del tubo es el resultado de que nuestros ojos mezclen los cuatro colores. Cada átomo tiene su propio espectro característico; no hay dos espectros atómicos iguales. La imagen de abajo muestra el espectro de emisión de hierro. Debido a que cada elemento tiene un espectro de emisión único, los elementos pueden definirse usándolos.
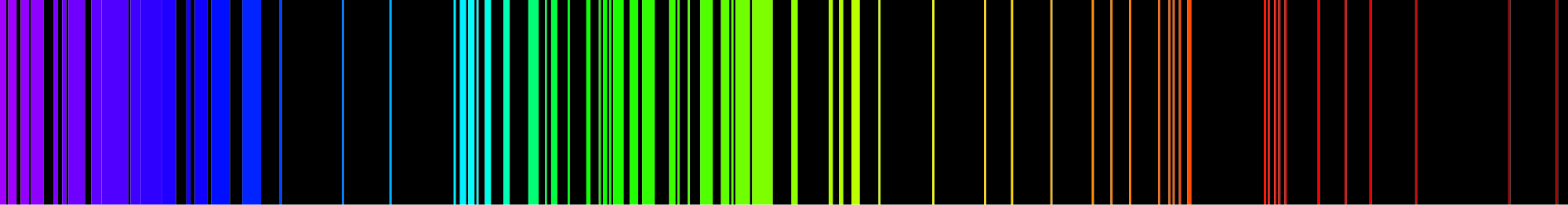
Es posible que hayas escuchado o leído sobre científicos discutiendo qué elementos están presentes en el sol o alguna estrella más distante, y después de escuchar eso, se preguntó cómo los científicos podían saber qué elementos estaban presentes en un lugar que nadie ha estado nunca. Los científicos determinan qué elementos están presentes en estrellas distantes analizando la luz que proviene de las estrellas y encontrando el espectro atómico de los elementos en esa luz. Si las cuatro líneas exactas que componen el espectro atómico del hidrógeno están presentes en la luz emitida por la estrella, ese elemento contiene hidrógeno.
Explicación de Bohr sobre los espectros de líneas
En 1913, el físico danés Niels Bohr propuso un modelo de la nube de electrones de un átomo en el que los electrones orbitan el núcleo y fueron capaces de producir espectros atómicos. Comprender el modelo de Bohr requiere cierto conocimiento de la radiación electromagnética (o luz). La idea clave de Bohr en su modelo del átomo es que los electrones ocupan orbitales definidos que requieren que el electrón tenga una cantidad específica de energía. Para que un electrón esté en la nube de electrones de un átomo, debe estar en

uno de los orbitales permisibles y debe tener la energía precisa requerida para esa órbita. Las órbitas más cercanas al núcleo requerirían cantidades menores de energía para un electrón y las órbitas más alejadas del núcleo requerirían que los electrones tuvieran una mayor cantidad de energía. Las órbitas posibles se conocen como niveles de energía (n). Una de las debilidades del modelo de Bohr era que no podía ofrecer una razón por la que solo se permitían ciertos niveles de energía u órbitas.
Figura\(\PageIndex{5}\): Niels Bohr con Albert Einstein en la casa de Paul Ehrenfest en Leiden (diciembre de 1925).

Bohr planteó la hipótesis de que la única forma en que los electrones podrían ganar o perder energía sería pasar de un nivel de energía a otro, ganando o perdiendo así cantidades precisas de energía. Se cuantifican los niveles de energía, lo que significa que solo son posibles cantidades específicas. Sería como una escalera que tuviera peldaños sólo a ciertas alturas. La única forma en que puedes estar en esa escalera es estar en uno de los peldaños y la única manera de moverte hacia arriba o hacia abajo sería moverte a uno de los otros peldaños. Supongamos que tuviéramos una escalera así con 10 peldaños. Otras reglas para la escalera son que solo una persona puede estar en un peldaño en estado normal y los ocupantes de la escalera deben estar en el peldaño más bajo disponible. Si la escalera tuviera cinco personas en ella, estarían en los cinco peldaños más bajos. Ante esta situación, ninguna persona podría bajar porque todos los peldaños inferiores están llenos. Bohr elaboró reglas para el número máximo de electrones que podrían estar en cada nivel de energía en su modelo y requirió que un átomo en su estado normal (estado fundamental) tuviera todos los electrones en los niveles de energía más bajos disponibles. En estas circunstancias, ningún electrón podría perder energía porque ningún electrón podría bajar a un nivel de energía más bajo. De esta manera, el modelo de Bohr explicó por qué los electrones que rodeaban el núcleo no emitían energía y espiraban hacia el núcleo.
Figura\(\PageIndex{6}\) Los niveles de energía (n= 1,2,3...) de los electrones pueden verse como peldaños en una escalera.
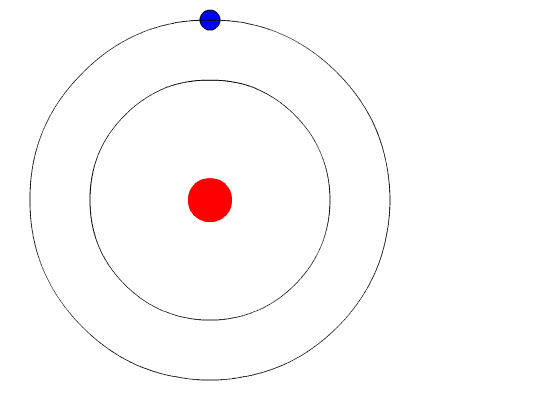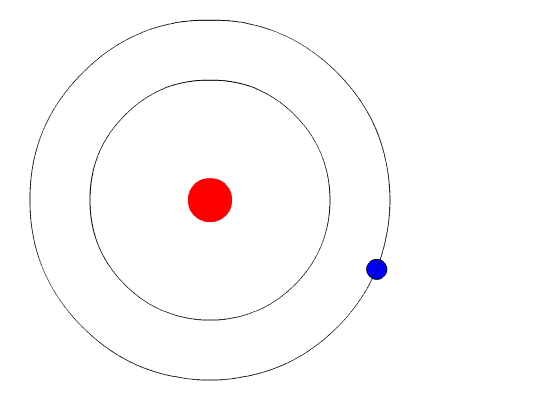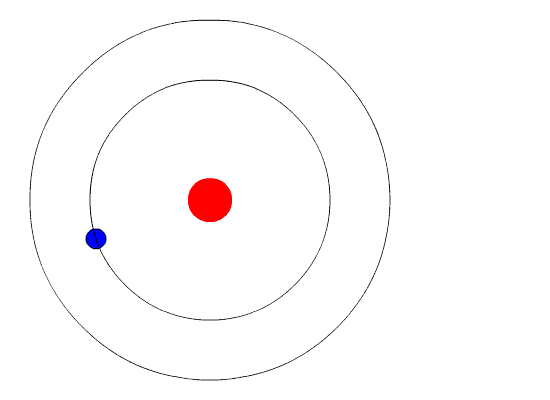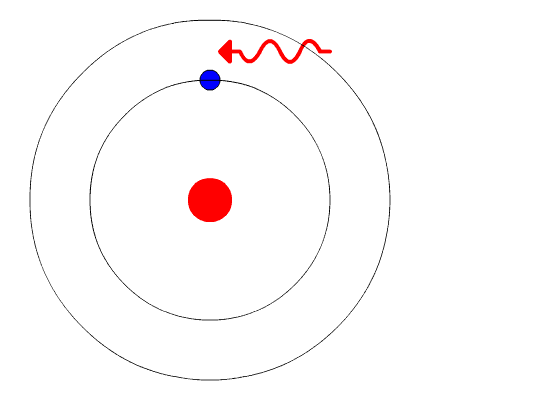
La evidencia utilizada para apoyar el modelo de Bohr provino de los espectros atómicos. Sugirió que un espectro atómico es hecho por los electrones en un átomo moviendo los niveles de energía.
Estados terrestres y estados emocionados
Los electrones suelen tener la energía más baja posible, llamada estado fundamental. Si a los electrones se les da energía (a través del calor, la electricidad, la luz, etc.) los electrones en un átomo podrían absorber energía saltando a un nivel de energía superior, o estado excitado. Los electrones entonces desprenden la energía en forma de un trozo de luz, llamado fotón, que habían absorbido para volver a caer a un nivel de energía más bajo. La energía emitida por los electrones que vuelven a caer a niveles de energía más bajos siempre serían cantidades precisas de energía porque las diferencias en los niveles de energía eran precisas. Esto explica por qué se ven líneas específicas de luz cuando se mira un espectro atómico - cada línea de luz coincide con un “paso hacia abajo” específico que un electrón puede tomar en ese átomo. Esto también explica por qué cada elemento produce un espectro atómico diferente. Debido a que cada elemento tiene diferentes niveles de energía aceptables para sus electrones, los posibles pasos que pueden tomar los electrones de cada elemento difieren de todos los demás elementos.
Con base en las longitudes de onda de las líneas espectrales, Bohr pudo calcular las energías que tendría el electrón de hidrógeno en cada uno de sus niveles de energía permitidos. Luego mostró matemáticamente qué transiciones de nivel de energía corresponden a las líneas espectrales en el espectro de emisión atómica (ver abajo).
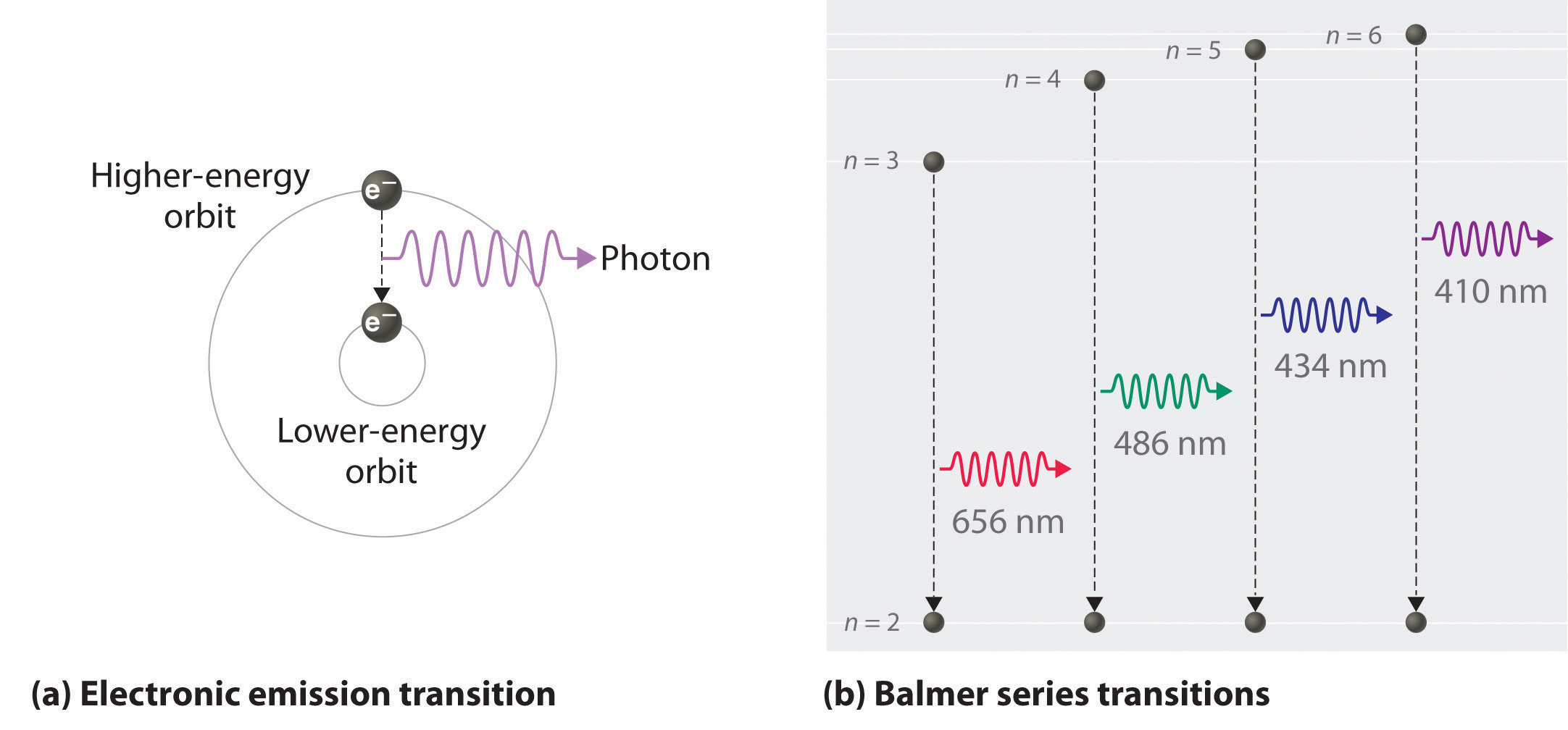
Encontró que las cuatro líneas espectrales visibles correspondían a transiciones desde niveles de energía más altos hasta el segundo nivel de energía\(\left( n=2 \right)\). A esto se le llama la serie Balmer (Figura\(\PageIndex{8}\) ). Las transiciones que terminan en el estado\(\left( n=1 \right)\) fundamental se llaman la serie Lyman, pero las energías liberadas son tan grandes que las líneas espectrales están todas en la región ultravioleta del espectro. Las transiciones llamadas serie Paschen y serie Brackett dan como resultado líneas espectrales en la región infrarroja porque las energías son demasiado pequeñas.
El modelo de Bohr fue un tremendo éxito al explicar el espectro del átomo de hidrógeno. Desafortunadamente, cuando las matemáticas del modelo se aplicaron a átomos con más de un electrón, no fue capaz de predecir correctamente las frecuencias de las líneas espectrales. Si bien el modelo de Bohr representó un gran avance en el modelo atómico y el concepto de transiciones electrónicas entre niveles de energía es válido, se necesitaron mejoras para comprender completamente todos los átomos y su comportamiento químico.
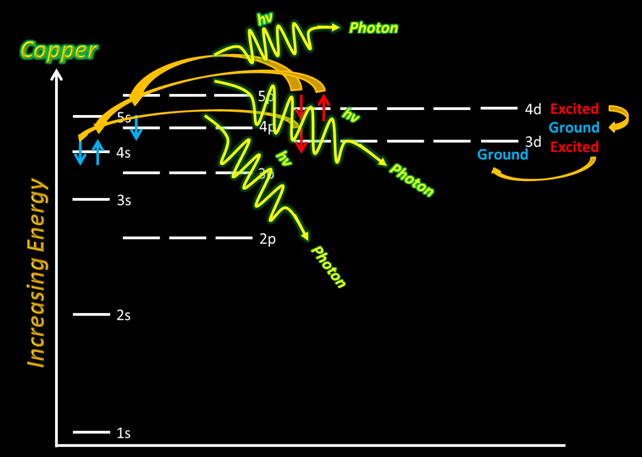
Diferentes electrones metálicos emiten diferentes longitudes de onda de luz para regresar a sus respectivos estados terrestres, por lo que los colores de las llamas son variados. Estas llamas pueden ser utilizadas para producir espectros de emmisión atómica de los elementos quemados. Usando valores conocidos de espectros de emisión, se puede realizar una prueba de llama en una sustancia desconocida, recopilar un espectro de emmisión a partir de ella y determinar qué elementos están en la sustancia desconocida.
Por ejemplo, en el caso del ion cobre, existen múltiples “caminos” diferentes que los electrones excitados pueden seguir para emitir fotones de cierta energía discreta. Esto produce múltiples líneas espectrales porque cada diferencia de nivel de energía discreta producirá una longitud de onda específica de luz, lo que determina el color.

Átomos de construcción: Conchas principales
Una capa de electrones es la parte exterior de un átomo alrededor del núcleo atómico. Se trata de un grupo de orbitales atómicos con el mismo valor del número cuántico principal\(n\). Las conchas de electrones tienen una o más subcapas de electrones, o subniveles. El nombre para las conchas de electrones proviene del modelo Bohr, en el que se creía que grupos de electrones rodeaban el núcleo a ciertas distancias, de manera que sus órbitas formaban “conchas”.
Una capa de electrones puede considerarse como una órbita seguida de electrones alrededor de un núcleo de átomo. Debido a que cada caparazón puede contener solo un número fijo de electrones, cada caparazón está asociado con un rango particular de energía de electrones, y así cada caparazón debe llenarse completamente antes de que los electrones puedan agregarse a una capa externa. Los electrones en la capa más externa determinan las propiedades químicas del átomo (ver Cáscara de Valence). Para una explicación de por qué los electrones existen en estas conchas ver configuración de electrones.

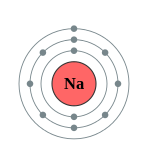
Figura \(\PageIndex{10}\)Un diagrama de carcasa de litio (izquierda) y sodio (derecha)
Las capas de electrones están etiquetadas como K, L, M, N, O, P y Q; o 1, 2, 3, 4, 5, 6 y 7; yendo desde la capa más interna hacia afuera. Los electrones en las cáscaras externas tienen mayor energía promedio y viajan más lejos del núcleo que los de las conchas internas. Esto los hace más importantes para determinar cómo reacciona químicamente el átomo y se comporta como conductor, porque la atracción del núcleo del átomo sobre ellos es más débil y se rompe más fácilmente. De esta manera, la reactividad de un elemento dado depende en gran medida de su configuración electrónica.
Video \(\PageIndex{1}\)Cómo dibujar el modelo de concha para azufre.
Nota: El número de electrones que pueden ocupar cada nivel de energía son 2 (primer nivel), 8 (2do nivel), 18 (3er nivel) y 32 (4º nivel) basados en la fórmula: # de electrones = 2 (n) 2, en donde n = nivel de energía principal.
En la tabla se\(\PageIndex{1}\) muestra el número de electrones que llenan cada caparazón para átomos neutros de varios elementos. Como se mencionó anteriormente, la capa más interna (correspondiente a la energía más baja) se llena primero y solo se permite un número fijo de electrones en cada caparazón. El único electrón en hidrógeno (Z=1) va a la primera capa. En el átomo de litio (Z=3), los dos electrones llenan la primera capa, y el tercer electrón va a la segunda capa. Un átomo de argón (Z=18) tiene 18 electrones. Los 10 electrones llenan la primera y segunda conchas, y los 8 electrones restantes van a la tercera capa. La configuración electrónica para elementos de paso de argón se cubre con más detalle en la sección 3.7.
|
Element Símbolo |
Número atónico* (Z) |
Primer Concha n=1 (2 electrones permitidos) |
Segunda Concha n=2 (8 electrones permitidos) |
Tercera Concha n=3 (18 electrones permitidos) |
|---|---|---|---|---|
| H | 1 | 1 | ||
| Él | 2 | 2 | ||
| C | 6 | 2 | 4 | |
| N | 7 | 2 | 5 | |
| Na | 11 | 2 | 8 | 1 |
| Mg | 12 | 2 | 8 | 2 |
| Cl | 17 | 2 | 8 | 7 |
| Ar | 18 | 2 | 8 | 8 |
Nota: * En un átomo neutro el número de protones es igual al número de electrones.
Resumen
- La radiación electromagnética tiene un amplio espectro, incluyendo rayos gamma, rayos X, rayos UV, luz visible, radiación IR, microondas y ondas de radio.
- Los diferentes colores de luz difieren en sus frecuencias (o longitudes de onda).
- El modelo de Bohr sugiere que cada átomo tiene un conjunto de niveles de energía inmutables y los electrones en la nube de electrones de ese átomo deben estar en uno de esos niveles de energía.
- El modelo de Bohr sugiere que los espectros atómicos de los átomos son producidos por electrones que ganan energía de alguna fuente, saltando a un nivel de energía más alto, luego volviendo a caer inmediatamente a un nivel de energía más bajo y emitiendo la energía diferente entre los dos niveles de energía.
- La existencia de los espectros atómicos es soporte para el modelo de Bohr del átomo.
- El modelo de Bohr solo tuvo éxito en el cálculo de los niveles de energía para el átomo de hidrógeno.
- El modelo de concha es una buena representación de la disposición de electrones solo para los elementos 1-18.
Colaboradores y Atribuciones
- Connections (John Hutchinson)
- Wikipedia
Henry Agnew (UC Davis)

