3.7: Arreglo de electrones- El modelo cuántico
- Page ID
- 72243
- Representar la organización de los electrones mediante una configuración electrónica basada en el modelo mecánico cuántico de un átomo.
La mecánica cuántica es el estudio del movimiento de objetos de tamaño atómico o subatómico y así demuestran la dualidad onda-partícula. Uno de los principios fundamentales (y más difíciles de entender) de la mecánica cuántica es que el electrón es a la vez una partícula y una onda. En el mundo macroscópico cotidiano de las cosas que podemos ver, algo no puede ser ambas cosas. Pero esta dualidad puede existir en el mundo cuántico de lo submicroscópico a escala atómica. 
En el corazón de la mecánica cuántica está la idea de que no podemos especificar con precisión la ubicación de un electrón. Todo lo que podemos decir es que existe una probabilidad de que exista dentro de este cierto volumen de espacio. El científico Erwin Schrödinger desarrolló una ecuación que trata de estos cálculos, que no vamos a perseguir en este momento. Recordemos que en el modelo Bohr, la trayectoria exacta del electrón estaba restringida a órbitas circulares muy bien definidas alrededor del núcleo. Una órbita es el refinamiento mecánico cuántico de la órbita de Bohr. En contraste con su concepto de una órbita circular simple con un radio fijo, los orbitales son regiones del espacio derivadas matemáticamente con diferentes probabilidades de tener un electrón.
Figura \(\PageIndex{1}\)El Erwin Schrödinger.
Construyendo átomos por llenado orbital
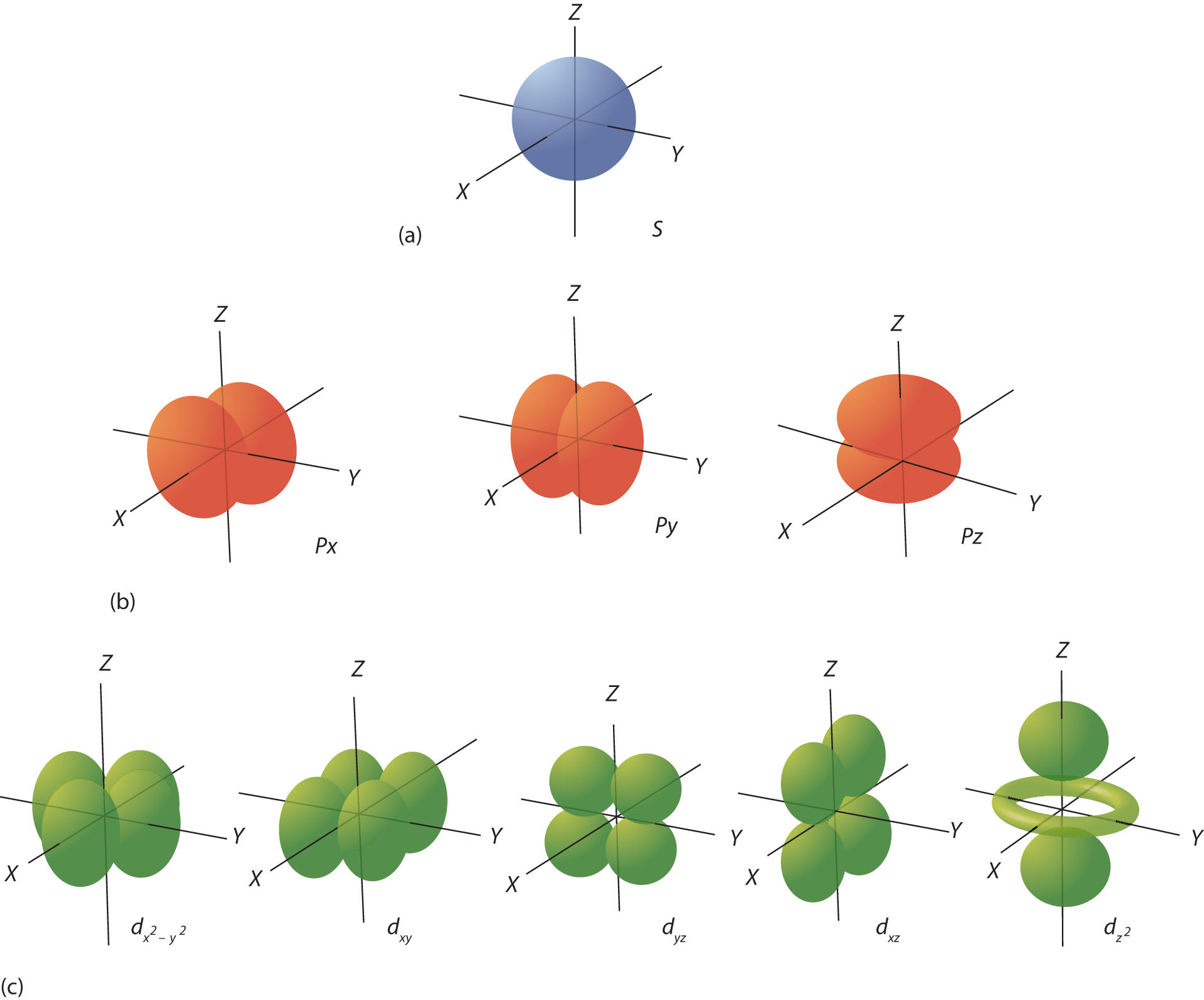
En el modelo cuánto-mecánico de un átomo, se dice que los electrones en el mismo átomo que tienen el mismo número cuántico principal (n) o nivel de energía principal ocupan una capa de electrones del átomo. Los orbitales definen regiones en el espacio donde es probable que encuentres electrones. Como se muestra en la Figura,\(\PageIndex{2}\) los orbitales son de forma esférica y los orbitales p tienen forma de mancuerna. Los orbitales dentro de un proyectil se dividen en subconchas (subniveles). Hay dos subproyectiles en el segundo caparazón, a saber, el subcaparazón 2s (con un orbital) y el subcaparazón 2p (con tres orbitales), ver Tabla\(\PageIndex{1}\). Cabe señalar que los diagramas de la Figura\(\PageIndex{2}\) son estimaciones de la distribución de electrones en el espacio, no las superficies en las que se fijan los electrones.
|
Número cuántico principal\(\left( n \right)\) (Concha principal) |
Subniveles (Subshell) |
Número de Orbitales por Subnivel |
Número de electrones por subnivel (Máximo de 2 electrones/orbital) |
|---|---|---|---|
| \ (\ left (n\ right)\) (Shell principal)” style="vertical-align:middle; "> 1 | 1s |
1 (1s) |
2 |
| \ (\ left (n\ right)\) (Shell principal)” rowspan="2" style="vertical-align:middle; "> 2 | 2s |
1 (2 s) |
2 |
| 2p |
3 (2px 2py 2pz) |
6 | |
| \ (\ left (n\ right)\) (Shell principal)” rowspan="3" style="vertical-align:middle; "> 3 | 3s |
1 (3) |
2 |
| 3p |
3 (3px 3py 3pz) |
6 | |
| 3d |
5 (refiérase a la Figura\(\PageIndex{2c}\)) |
10 |
En contraste con el modelo de concha discutido en la sección 3.6, los químicos utilizan con mayor frecuencia una configuración electrónica más detallada para representar la organización de electrones en conchas y subconchas en un átomo. La configuración electrónica de un átomo incluye las etiquetas shell y subshell, con un superíndice derecho que da el número de electrones en esa subcapa. Las conchas y subconchas se enumeran en el orden de llenado. Los electrones se organizan típicamente alrededor de un átomo comenzando primero en los números cuánticos más bajos posibles, que son las cáscaras subcáscaras con energías más bajas.
Por ejemplo, un átomo de H tiene un solo electrón en la subcapa 1s. Su configuración electrónica es H: 1s 1
Tiene dos electrones en la subcapa 1s. Su configuración electrónica es He: 1s 2
Los tres electrones para Li están dispuestos en la subcapa 1s (dos electrones) y la subcapa 2s (un electrón). La configuración electrónica de Li es
Li: 1s 2 2s 1
Figura\(\PageIndex{3}\) El diagrama de una configuración electrónica de hidrógeno derecho
especifica la subcapa y el número superíndice de electrones.
| Nombre del elemento | Símbolo | Número atómico | Configuración de electrones |
|---|---|---|---|
| Hidrógeno | \(\ce{H}\) | 1 | \(1s^1\) |
| Helio | \(\ce{He}\) | 2 | \(1s^2\) |
| Litio | \(\ce{Li}\) | 3 | \(1s^2 2s^1\) |
| Berilio | \(\ce{Be}\) | 4 | \(1s^2 2s^2\) |
| Boro | \(\ce{B}\) | 5 | \(1s^2 2s^2 2p^1\) |
| Carbono | \(\ce{C}\) | 6 | \(1s^2 2s^2 2p^2\) |
| Nitrógeno | \(\ce{N}\) | 7 | \(1s^2 2s^2 2p^3\) |
| Oxígeno | \(\ce{O}\) | 8 | \(1s^2 2s^2 2p^4\) |
| Flúor | \(\ce{F}\) | 9 | \(1s^2 2s^2 2p^5\) |
| Neón | \(\ce{Ne}\) | 10 | \(1s^2 2s^2 2p^6\) |
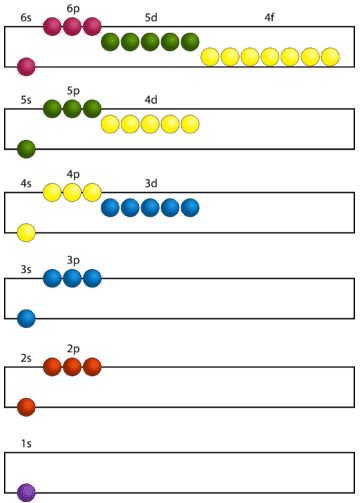
Para crear configuraciones electrónicas de estado fundamental para cualquier elemento, es necesario conocer la forma en que se organizan los subniveles atómicos en orden de aumentar la energía. La figura\(\PageIndex{4}\) muestra el orden de aumento de la energía de los subniveles.
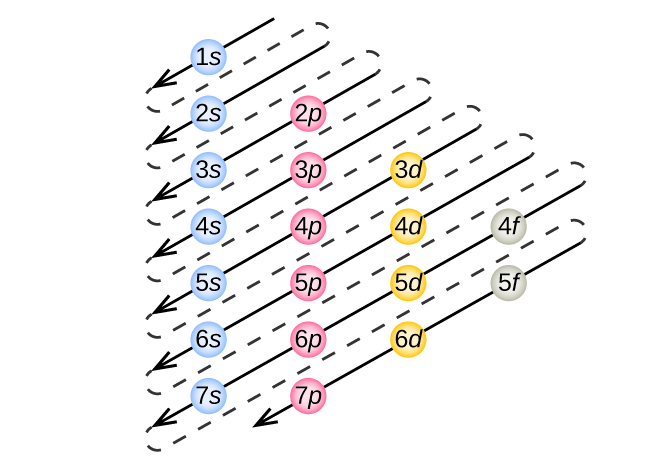
La figura\(\PageIndex{5}\) ilustra la forma tradicional de recordar el orden de llenado de los orbitales atómicos.
El nitrógeno tiene 7 electrones. Escriba la configuración electrónica para el nitrógeno.
Solución:
Eche un vistazo de cerca a la Figura 9.6.5, y úsela para averiguar cuántos electrones entran en cada subnivel, y también el orden en que se llenan los diferentes subniveles.
1. Comience llenando el subnivel de 1 s. Esto da 1 s 2. Ahora todos los orbitales en el bloque rojo n = 1 están llenos.
- Como usamos 2 electrones, quedan 7 − 2 = 5 electrones
2. A continuación, llenar el subnivel 2 s. Esto da 1 s 2 2 s 2. Ahora se llenan todos los orbitales en el subnivel s del bloque naranja n = 2.
- Como usamos otros 2 electrones, quedan 5 − 2 = 3 electrones
3. Observe que aún no hemos llenado todo el bloque n = 2... ¡todavía quedan los orbitales p!
- Los 3 electrones finales entran en el subnivel 2 p. Esto da 1 s 2 2 s 2 2 p 3
La configuración electrónica global es: 1 s 2 2 s 2 2 p 3.
El potasio tiene 19 electrones. Escriba el código de configuración electrónica para el potasio.
Solución
Esta vez, eche un vistazo de cerca a la Figura 9.6.5.
1. Comience llenando el subnivel de 1 s. Esto da 1 s 2. Ahora se llena el nivel n = 1.
- Como usamos 2 electrones, quedan 19 − 2 = 17 electrones
2. A continuación, llenar el subnivel 2 s. Esto da 1 s 2 2 s 2
- Como usamos otros 2 electrones, quedan 17 − 2 = 15 electrones
3. A continuación, llenar el subnivel 2 p. T his da 1 s 2 2 s 2 2 p 6. Ahora se llena el nivel n = 2.
- Como usamos otros 6 electrones, quedan 15 − 6 = 9 electrones
4. A continuación, llenar el subnivel 3 s. Esto da 1 s 2 2 s 2 p 6 3 s 2
- Como usamos otros 2 electrones, quedan 9 − 2 = 7 electrones
5. A continuación, llenar el subnivel 3 p. Esto da 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6
- Como usamos otros 6 electrones, quedan 7 − 6 = 1 electrón
Aquí es donde tenemos que tener cuidado — justo después de 3 p 6!!
- Recuerda, ¡4 s viene antes de los 3 d!
6. El electrón final entra en el subnivel de 4 s. Esto da 1 s 2 2 s 2 p 6 3 s 2 3 p 6 4 s 1
La configuración electrónica global es: 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 1.
¿Cuál es la configuración electrónica para Mg y Na?
- Respuesta Mg
- Mg: 1s 2 2s 2 2p 6 3s 2
- Responder Na
- Na: 1s 2 2s 2 2p 6 3s 1
Resumen
- Los orbitales definen regiones en el espacio donde es probable que encuentres electrones. s orbitales son de forma esférica. p orbitales tienen forma de mancuerna. Los tres posibles orbitales p son siempre perpendiculares entre sí.
- La notación de configuración electrónica simplifica la indicación de dónde se encuentran los electrones en un átomo específico. Los superíndices se utilizan para indicar el número de electrones en un subnivel dado.
- Los electrones se agregan a los orbitales atómicos en orden de baja energía a alta energía.
Colaboradores y Atribuciones
CK-12 Foundation by Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson, and Jean Dupon.
Henry Agnew (UC Davis)
Paul Flowers (University of North Carolina - Pembroke), Klaus Theopold (University of Delaware) and Richard Langley (Stephen F. Austin State University) with contributing authors. Textbook content produced by OpenStax College is licensed under a Creative Commons Attribution License 4.0 license. Download for free at http://cnx.org/contents/85abf193-2bd...a7ac8df6@9.110).
- TextMap: Beginning Chemistry (Ball et al.)

