4.1: El arte de la deducción - Configuraciones de electrones estables
- Page ID
- 72267
- Definir la regla del octeto.
La regla del octeto es una regla química que refleja la observación de que los elementos tienden a enlazarse de tal manera que cada átomo tiene ocho electrones en su caparazón de valencia, dándole la misma configuración electrónica que un gas noble.
Refiriéndose a la regla del octeto, los átomos intentan obtener una configuración electrónica de gas noble, que es ocho electrones de valencia. Los metales tienen pocos electrones en sus orbitales más exteriores. Al perder esos electrones, estos metales pueden lograr la configuración de gas noble y satisfacer la regla del octeto. El sodio tiene un electrón de valencia, por lo que renunciar a él daría como resultado la misma configuración de electrones que el neón. Debido a la pérdida de electrones, se forma un catión cargado positivamente (Na +) llamado ion sodio.
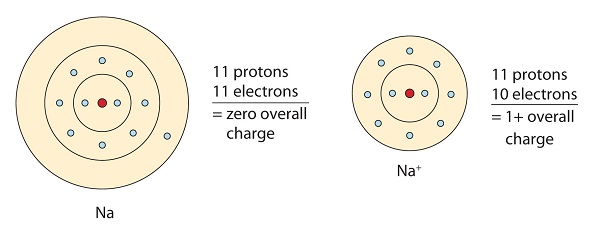
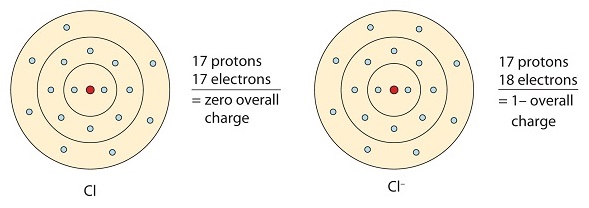
Del mismo modo, los no metales que tienen cerca de 8 electrones en sus cáscaras de valencia tienden a aceptar fácilmente electrones para lograr la configuración de gas noble. El cloro tiene siete electrones de valencia, así que si toma uno tendrá ocho (un octeto). El cloro tiene la configuración electrónica del argón cuando gana un electrón. El ion resultante (Cl -) se llama ion cloruro.
La regla del octeto podría haberse satisfecho si el cloro cedía los siete electrones de valencia y el sodio se los hubiera llevado. En ese caso, ambos tendrían las configuraciones electrónicas de gases nobles, con una concha de valencia completa. No obstante, sus cargos serían mucho mayores. Sería Na 7 - y Cl 7 +, que es mucho menos estable que Na + y Cl -. Los átomos son más estables cuando no tienen carga, o una carga pequeña.
Resumen
La regla del octeto se refiere a la tendencia de los átomos a preferir tener ocho electrones en la capa de valencia.
Colaborador
Química Orgánica Suplemental_Modules_ (Organic_Chemistry) /Fundamentales/Ionic_and_covalent_bonds

