4.2: Símbolos de Lewis (Electron-Dot)
( \newcommand{\kernel}{\mathrm{null}\,}\)
- Dibuja un diagrama de puntos electrónicos de Lewis para un átomo.
- Conoce la importancia del punto Lewis en la unión.
A principios del siglo XX, un químico físico estadounidense G. N. Lewis (1875—1946) ideó un sistema de símbolos, ahora llamados símbolos de punto electrónico de Lewis (a menudo abreviados a símbolos de punto de Lewis) que pueden usarse para predecir el número de enlaces formados por la mayoría de los elementos en sus compuestos.

- representación conveniente de electrones de valencia
- permite a los científicos realizar un seguimiento de los electrones de valencia durante la formación de enlaces
- consiste en el símbolo atómico para el elemento más un punto para cada electrón de valencia
Para escribir el símbolo de punto de Lewis de un elemento, colocamos puntos que representan sus electrones de valencia, uno a la vez, alrededor del símbolo químico del elemento. Se colocan hasta cuatro puntos arriba, abajo, a la izquierda y a la derecha del símbolo (en cualquier orden, siempre y cuando los elementos con cuatro o menos electrones de valencia no tengan más de un punto en cada posición). Los siguientes puntos, para elementos con más de cuatro electrones de valencia, se distribuyen de nuevo uno a la vez, cada uno emparejado con uno de los cuatro primeros. Por ejemplo, el elemento azufre tiene seis electrones de valencia (anote el número romano arriba del grupo en la tabla periódica) y su símbolo de Lewis sería:
El flúor, por ejemplo, tiene siete electrones de valencia, por lo que su símbolo de punto Lewis se construye de la siguiente manera:
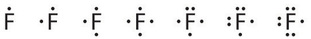
Lewis finalmente publicó su teoría de la unión química en 1916. La formación de enlaces químicos para completar el requerimiento de ocho electrones para el átomo se convierte en una tendencia natural. Aquí se dan símbolos de punto Lewis de los dos primeros periodos para ilustrar este punto. De hecho, todo el grupo (columna) de elementos tiene los mismos símbolos de punto de Lewis, porque tienen el mismo número de electrones de valencia.
Al repasar la tabla periódica, vemos que los símbolos de punto electrónico de Lewis de los átomos nunca tendrán más de ocho puntos alrededor del símbolo atómico ver Tabla\PageIndex{1}.
| \ce{H\cdot} | \textrm{He:} | ||||||
|---|---|---|---|---|---|---|---|
\underset{\:}{\ce{Li\cdot}} |
\underset{\:}{\ce{\cdot Be \cdot}} |
\ (\ ce { \ c punto \ underset {\:} {\ overset {\ grande {\ cdot}} {B}}\ cdot} \ cdot}\) |
\ (\ ce { \ cdot \ underset {\ grande {\ cdot}} {\ overset {\ grande {\ cdot}} {C}\ cdot} \ cdot}\) |
\ ( \ underset {\ grande {\ cdot\,}} {\ overset {\ grande {\ cdot}} {\ textrm {:N}\ cdot}} \) |
\ ( \ underset {\ grande {\ cdot\ cdot\,}} {\ overset {\ grande {\ cdot}} {\ textrm {:O}\ cdot}} \) |
\ ( \ underset {\ grande {\ cdot\ cdot}} {\ overset {\ grande {\ cdot\ cdot}} {\ textrm {:F}\ cdot}} \) |
\ ( \ underset {\ Large {\ cdot\ cdot}} {\ overset {\ Large {\ cdot\ cdot}} {\ textrm {:Ne:}}} \) |
| \ce{Na} \ce{K} \ce{Rb} \ce{Cs} |
\ce{Mg} \ce{Ca} \ce{Sr} \ce{Ba} |
\ce{Al} \ce{Ga} \ce{In} \ce{Tl} |
\ce{Si} \ce{Ge} \ce{Sn} \ce{Pb} |
\ce{P} \ce{As} \ce{Sb} \ce{Bi} |
\ce{S} \ce{Se} \ce{Te} \ce{Po} |
\ce{Cl} \ce{Br} \ce{I} \ce{At} |
\ce{Ar} \ce{Kr} \ce{At} \ce{Rn} |
¿Cuál es el diagrama de puntos electrónicos de Lewis para cada elemento?
- aluminio
- selenio
Solución
- La configuración de electrones de valencia para el aluminio es de 3 s 2 3 p 1. Entonces tendría tres puntos alrededor del símbolo para aluminio, dos de ellos emparejados para representar los electrones de 3 s:
\dot{Al:} \nonumber
- La configuración electrónica de valencia para selenio es 4 s 2 4 p 4. En el caparazón de mayor número, el caparazón n = 4, hay seis electrones. Su diagrama de puntos electrónicos es el siguiente:
\mathbf{\cdot }\mathbf{\dot{\underset{.\: .}Se}}\mathbf{:} \nonumber
¿Cuál es el diagrama de puntos electrónicos de Lewis para cada elemento?
- fósforo
- argón
- Contestar a
-
\mathbf{\cdot }\mathbf{\dot{\underset{.}P}}\mathbf{:} \nonumber
- Respuesta b
-
\mathbf{:}\mathbf{\ddot{\underset{.\, .}Ar}}\mathbf{:} \nonumber
Resumen
- Los diagramas de puntos electrónicos de Lewis utilizan puntos para representar electrones de valencia alrededor de un símbolo atómico.
- Los símbolos de punto de Lewis se pueden usar para predecir el número de enlaces formados por elementos en un compuesto.
Colaboradores y Atribuciones
- Wikipedia
- National Programme on Technology Enhanced Learning (India)
Isabella Quiros (Furman University)

