7.7: Bufferes y Pares Ácido Base Conjugado
- Page ID
- 72024
- Identificar par de bases ácidas conjugadas.
- Definir tampones y conocer la composición de diferentes sistemas de búfer.
- Describir cómo funcionan los búferes.
Par Acido-Base Conjugado
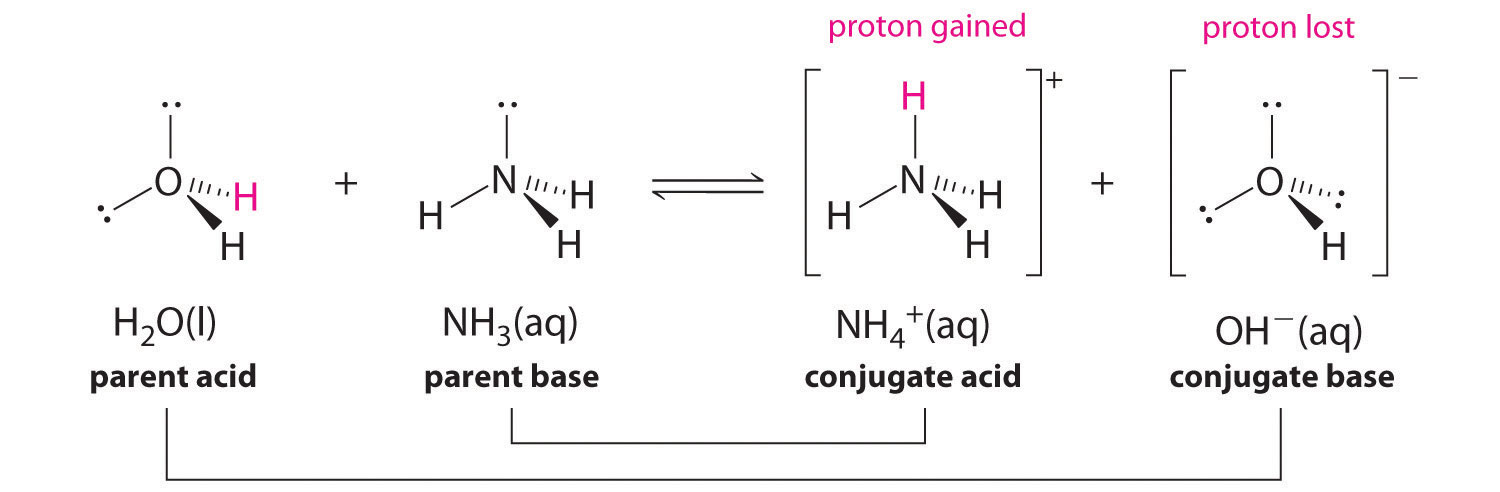
En realidad, todas las reacciones ácido-base implican la transferencia de protones entre ácidos y bases. Por ejemplo, considere la reacción ácido-base que tiene lugar cuando el amoníaco se disuelve en agua. Una molécula de agua (que funciona como un ácido) transfiere un protón a una molécula de amoníaco (que funciona como una base), produciendo la base conjugada del agua\(\ce{OH^-}\), y el ácido conjugado del amoníaco,\(\ce{NH4+}\):
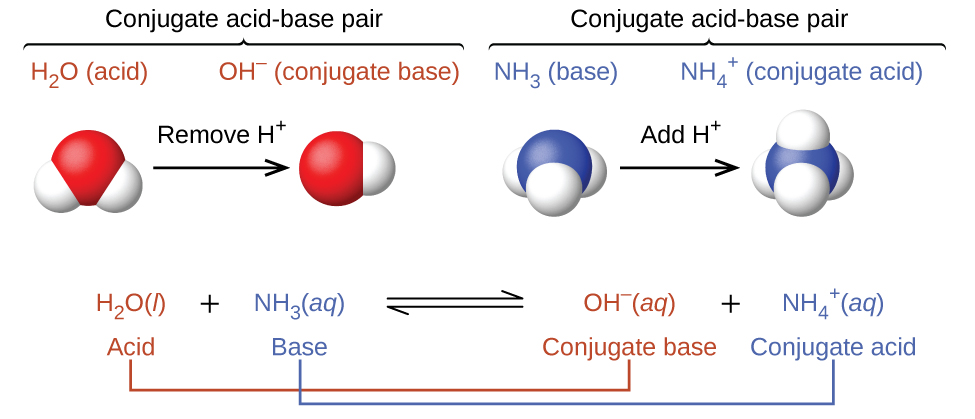
En la reacción del amoníaco con agua para dar iones amonio e iones hidróxido, el amoníaco actúa como base al aceptar un protón de una molécula de agua, lo que en este caso significa que el agua está actuando como un ácido. En la reacción inversa, un ion amonio actúa como un ácido donando un protón a un ion hidróxido, y el ion hidróxido actúa como base. Los pares de ácido-base conjugados para esta reacción son\(NH_4^+/NH_3\) y\(H_2O/OH^−\).
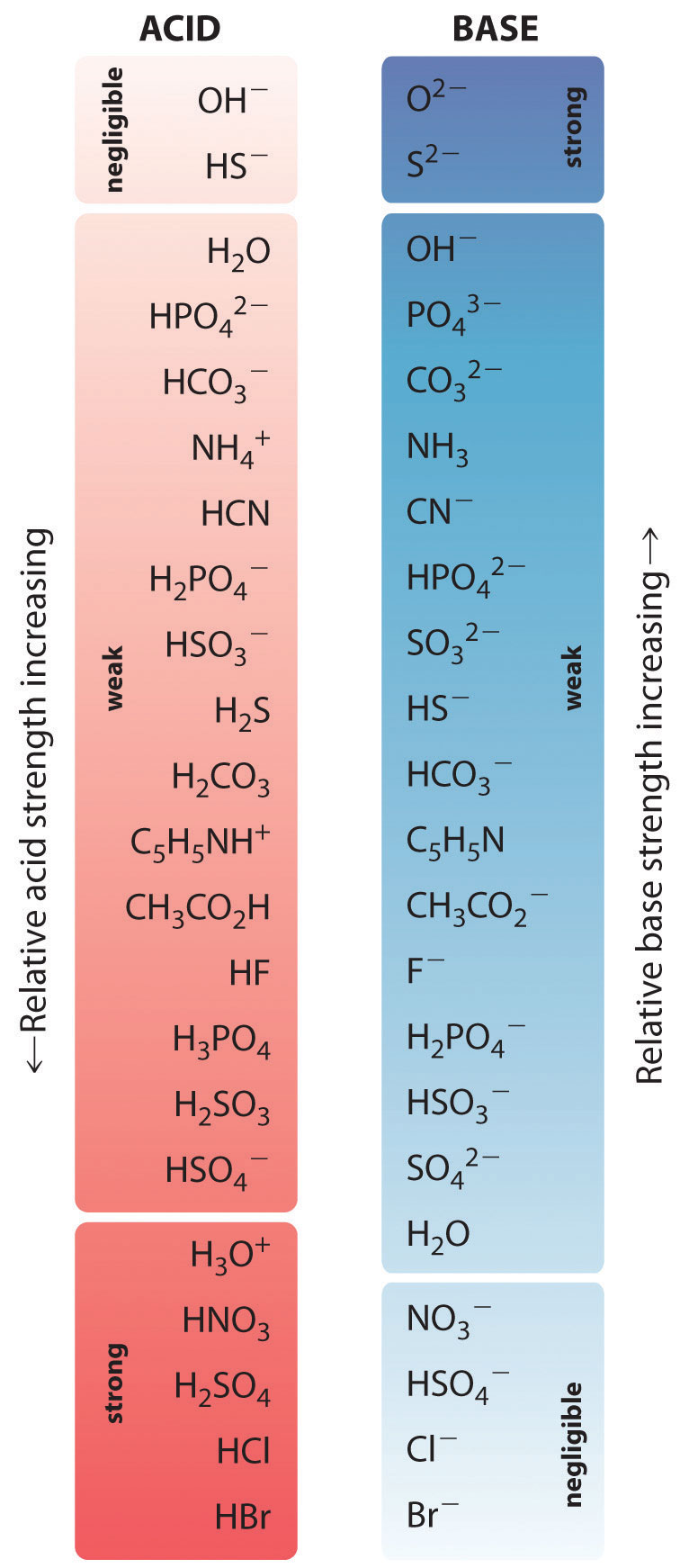
Los ácidos más fuertes están en la parte inferior izquierda, y las bases más fuertes están en la parte superior derecha. La base conjugada de un ácido fuerte es una base muy débil, y, a la inversa, el ácido conjugado de una base fuerte es un ácido muy débil.
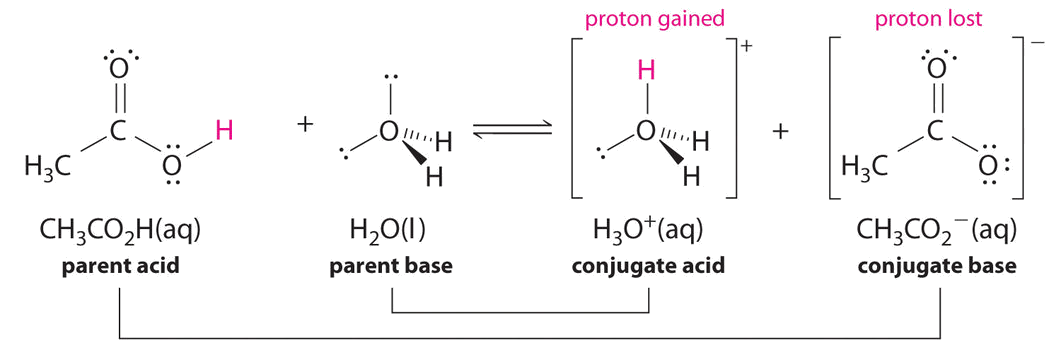
Identificar los pares ácido-base conjugados en este equilibrio.
\[\ce{CH3CO2H + H2O <=> H3O^{+} + CH3CO2^{-}} \nonumber \]
Solución
De igual manera, en la reacción del ácido acético con agua, el ácido acético dona un protón al agua, que actúa como base. En la reacción inversa,\(H_3O^+\) se encuentra el ácido que dona un protón al ion acetato, que actúa como base.
Una vez más, tenemos dos pares de ácido-base conjugados:
- el ácido parental y su base conjugada (\(CH_3CO_2H/CH_3CO_2^−\)) y
- la base parental y su ácido conjugado (\(H_3O^+/H_2O\)).
Identificar los pares ácido-base conjugados en este equilibrio.
\[(CH_{3})_{3}N + H_{2}O\rightleftharpoons (CH_{3})_{3}NH^{+} + OH^{-} \nonumber \]
Solución
Un par es H 2 O y OH −, donde H 2 O tiene uno más H + y es el ácido conjugado, mientras que OH − tiene uno menos H + y es la base conjugada.
El otro par consiste en (CH 3) 3 N y (CH 3) 3 NH +, donde (CH 3) 3 NH + es el conjugado ácido (tiene un protón adicional) y (CH 3) 3 N es la base conjugada.
Identificar los pares ácido-base conjugados en este equilibrio.
\[\ce{NH2^{-} + H2O\rightleftharpoons NH3 + OH^{-}} \nonumber \]
- Respuesta:
- H 2 O (ácido) y OH − (base); NH 2 − (base) y NH 3 (ácido)
Soluciones Buffer
Los ácidos débiles son relativamente comunes, incluso en los alimentos que comemos. Pero ocasionalmente nos encontramos con un ácido o base fuerte, como el ácido estomacal, que tiene un pH fuertemente ácido de 1.7. Por definición, los ácidos y bases fuertes pueden producir una cantidad relativamente grande de iones H + u OH − y en consecuencia tienen actividades químicas marcadas. Además, cantidades muy pequeñas de ácidos y bases fuertes pueden cambiar el pH de una solución muy rápidamente. Si se agregara 1 mL de ácido estomacal [aproximado como HCl (ac) 0.1 M] al torrente sanguíneo y no hubiera ningún mecanismo de corrección, el pH de la sangre disminuiría de aproximadamente 7.4 a aproximadamente 4.7—un pH que no es propicio para continuar viviendo. Afortunadamente, el cuerpo tiene un mecanismo para minimizar cambios de pH tan dramáticos.
Este mecanismo involucra un tampón, una solución que resiste cambios dramáticos en el pH. Los tampones lo hacen al estar compuestos por ciertos pares de solutos: ya sea un ácido débil más una sal derivada de ese ácido débil, o una base débil más una sal de esa base débil. Por ejemplo, un tampón puede estar compuesto por HC 2 H 3 O 2 disueltos (un ácido débil) y NaC 2 H 3 O 2 (la sal derivada de ese ácido débil). Otro ejemplo de un tampón es una solución que contiene NH 3 (una base débil) y NH 4 Cl (una sal derivada de esa base débil).
Usemos un búfer HC 2 H 3 O 2 /Nac 2 H 3 O 2 para demostrar cómo funcionan los buffers. Si se añade una base fuerte, una fuente de iones OH - (ac), a la solución tampón, esos iones OH - reaccionarán con el HC 2H 3 O 2 en una reacción ácido-base:
\[\ce{HC2H3O2(aq) + OH^{-}(aq) \rightarrow H2O(ℓ) + C2H3O^{-}2(aq)} \label{Eq1} \]
En lugar de cambiar drásticamente el pH haciendo básica la solución, los iones OH − añadidos reaccionan para hacer H 2 O, por lo que el pH no cambia mucho.
Si se agrega un ácido fuerte, una fuente de iones H +, a la solución tampón, los iones H + reaccionarán con el anión de la sal. Debido a que HC 2 H 3 O 2 es un ácido débil, no se ioniza mucho. Esto significa que si muchos iones H + y C 2 H 3 O 2 − están presentes en la misma solución, se unirán para hacer HC 2 H 3 O 2:
\[\ce{H^{+}(aq) + C2H3O^{−}2(aq) \rightarrow HC2H3O2(aq)} \label{Eq2} \]
En lugar de cambiar drásticamente el pH y hacer que la solución sea ácida, los iones H + añadidos reaccionan para hacer moléculas de un ácido débil. La figura\(\PageIndex{2}\) ilustra ambas acciones de un búfer.

Los tampones elaborados a partir de bases débiles y sales de bases débiles actúan de manera similar. Por ejemplo, en un tampón que contiene NH 3 y NH 4 Cl, las moléculas de NH 3 pueden reaccionar con cualquier exceso de iones H + introducidos por ácidos fuertes:
NH 3 (aq) + H + (aq) → NH 4 + (aq)
mientras que el ion NH 4 + (ac) puede reaccionar con cualquier ion OH − introducido por bases fuertes:
NH 4 + (aq) + OH − (aq) → NH 3 (aq) + H 2 O (l)
Algunos sistemas de búfer comunes se enumeran en la siguiente tabla.
| Tabla\(\PageIndex{1}\) Algunos búferes comunes | ||
|---|---|---|
| \ (\ PageIndex {1}\) Algunos búferes comunes” style="vertical-align:middle; "> Sistema de búfer | Componentes de búfer | pH del tampón (molaridades iguales de ambos componentes) |
| \ (\ PageIndex {1}\) Algunos tampones comunes” style="vertical-align:middle; ">Ácido acético/ion acetato | \(\ce{CH_3COOH}\)/\(\ce{CH_3COO^-}\) | 4.74 |
| \ (\ PageIndex {1}\) Algunos tampones comunes” style="vertical-align:middle; ">Ácido carbónico/ion carbonato de hidrógeno | \(\ce{H_2CO_3}\)/\(\ce{HCO_3^-}\) | 6.38 |
| \ (\ PageIndex {1}\) Algunos tampones comunes” style="vertical-align:middle; ">Ion fosfato dihidrógeno/ion fosfato de hidrógeno | \(\ce{H_2PO_4^-}\)/\(\ce{HPO_4^{2-}}\) | 7.21 |
| \ (\ PageIndex {1}\) Algunos búferes comunes” style="vertical-align:middle; ">Amonia/ion amonio | \(\ce{NH_3}\)/\(\ce{NH_4^+}\) | 9.25 |
Los tampones funcionan bien solo para cantidades limitadas de ácido fuerte o base agregados. Una vez que cualquiera de los solutos ha reaccionado completamente, la solución ya no es un tampón y pueden ocurrir cambios rápidos en el pH. Decimos que un buffer tiene cierta capacidad. Los tampones que tienen más soluto disuelto en ellos para empezar tienen mayores capacidades, como cabría esperar.
La sangre humana tiene un sistema de tamponamiento para minimizar los cambios extremos en el pH. Un tampón en sangre se basa en la presencia de HCO 3 − y H 2 CO 3 [el segundo compuesto es otra forma de escribir CO 2 (aq)]. Con este tampón presente, aunque algún ácido estomacal encontrara su camino directamente en el torrente sanguíneo, el cambio en el pH de la sangre sería mínimo. Dentro de muchas de las células del cuerpo, hay un sistema de amortiguación basado en iones fosfato.
¿Qué combinaciones de compuestos pueden hacer una solución tampón?
- HCHO 2 y NaChO 2
- HCl y NaCl
- CH 3 NH 2 y CH 3 NH 3 Cl
- NH 3 y NaOH
Solución
- HCHO 2 es ácido fórmico, un ácido débil, mientras que NaChO 2 es la sal hecha del anión del ácido débil (el ion formiato [CHO 2 −]). La combinación de estos dos solutos haría una solución tampón.
- El HCl es un ácido fuerte, no un ácido débil, por lo que la combinación de estos dos solutos no haría una solución tampón.
- CH 3 NH 2 es metilamina, que es como NH 3 con uno de sus átomos de H sustituido con un grupo CH 3. Debido a que no está listado en la Tabla\(\PageIndex{1}\), podemos suponer que es una base débil. El compuesto CH 3 NH 3 Cl es una sal elaborada a partir de esa base débil, por lo que la combinación de estos dos solutos haría una solución tampón.
- NH 3 es una base débil, pero el NaOH es una base fuerte. La combinación de estos dos solutos no haría una solución tampón.
¿Qué combinaciones de compuestos pueden hacer una solución tampón?
- NaHCO 3 y NaCl
- H 3 PO 4 y NaH 2 PO 4
- NH 3 y (NH 4) 3 PO 4
- NaOH y NaCl
- Responder a
- Sí.
- Respuesta b
- No. Necesita un ácido o base débil y una sal de su base conjugada o ácido.
- Respuesta c
- Sí.
- Respuesta d
- No. Necesita una base o ácido débil.
Si bien los medicamentos no son exactamente “comida y bebida”, sí los ingerimos, así que echemos un vistazo a un ácido que probablemente sea el medicamento más común: el ácido acetilsalicílico, también conocido como aspirina. La aspirina es bien conocida como analgésico y antipirético (reductor de fiebre).
La estructura de la aspirina se muestra en la figura adjunta. La parte ácida está encerrada en un círculo; es el átomo de H en esa parte que se puede donar ya que la aspirina actúa como un ácido de Brønsted-Lowry. Debido a que no se da en la Tabla\(\PageIndex{1}\), el ácido acetilsalicílico es un ácido débil. No obstante, sigue siendo un ácido, y dado que algunas personas consumen diariamente cantidades relativamente grandes de aspirina, su naturaleza ácida puede ocasionar problemas en el revestimiento del estómago, a pesar de las defensas del estómago frente a su propio ácido estomacal.

Debido a que las propiedades ácidas de la aspirina pueden ser problemáticas, muchas marcas de aspirina ofrecen una forma de “aspirina tamponada” del medicamento. En estos casos, la aspirina también contiene un agente tampón, generalmente MgO, que regula la acidez de la aspirina para minimizar sus efectos secundarios ácidos.
Tan útil y común como es la aspirina, se comercializó formalmente como fármaco a partir de 1899. La Administración de Alimentos y Medicamentos de Estados Unidos (FDA), la agencia gubernamental encargada de supervisar y aprobar medicamentos en Estados Unidos, no se formó hasta 1906. Algunos han argumentado que si la FDA se había formado antes de que se introdujera la aspirina, es posible que la aspirina nunca haya obtenido la aprobación debido a su potencial de efectos secundarios: sangrado gastrointestinal, zumbido en los oídos, síndrome de Reye (un problema hepático) y algunas reacciones alérgicas. Sin embargo, recientemente la aspirina ha sido promocionada por sus efectos en la disminución de ataques cardíacos y accidentes cerebrovasculares, por lo que es probable que la aspirina permanezca en el mercado.
Resumen
- Un tampón es una solución que resiste cambios repentinos en el pH.
- Se describen reacciones que muestran cómo los tampones regulan el pH.
Colaboradores y Atribuciones
CK-12 Foundation by Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson, and Jean Dupon.
- TextMap: Beginning Chemistry (Ball et al.)

