7.8: Ácidos y Bases en la Industria y en la Vida Diaria
- Page ID
- 72062
- Conocer los múltiples usos de los ácidos y bases comunes.
Antiácidos: Un remedio básico
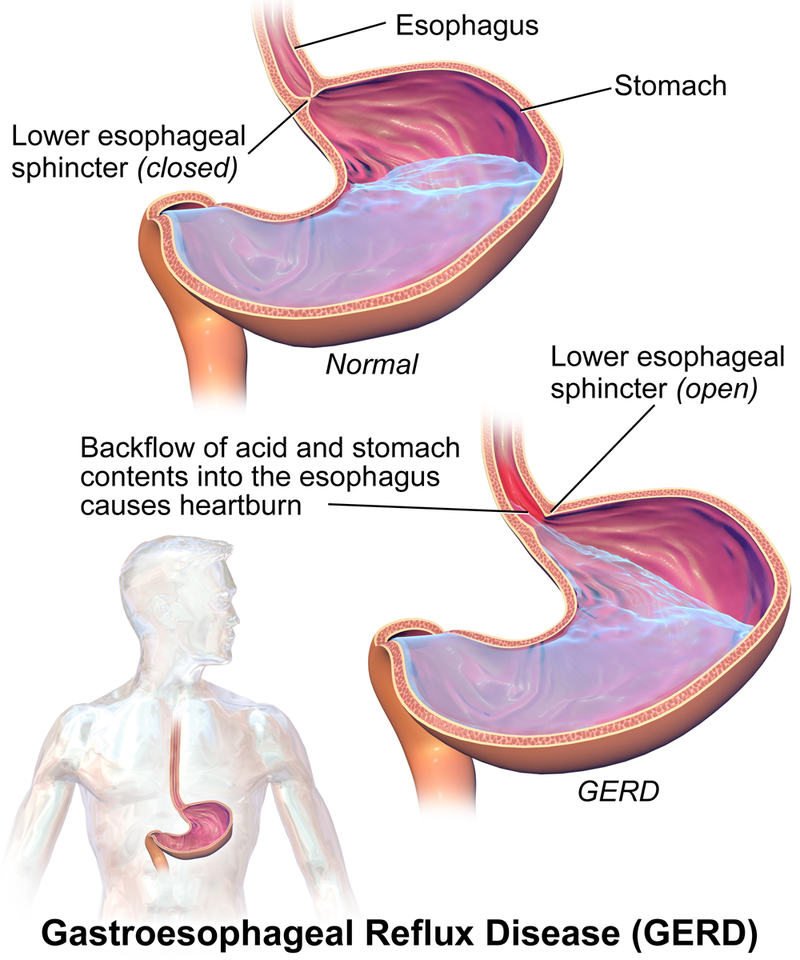
Los antiácidos contienen iones alcalinos que neutralizan químicamente el ácido gástrico estomacal, reduciendo el daño y aliviando el dolor. Por ejemplo, Tums es un antiácido de uso muy común que se puede comprar sobre el mostrador. Otros antiácidos, como Alka Seltzer, funcionan de manera similar. A continuación, se muestran el mecanismo y los productos de reacción en los que el carbonato de calcio (el ingrediente activo en Tums) neutraliza el HCl en una simple reacción de transferencia de protones.
CaCo 3 (s) + HCl (ac) → H 2 CO 3 (ac) + CaCl 2 (aq)
Después de esta reacción ácido-base, el ácido carbónico se degrada rápidamente en CO 2 y H 2 O.
H 2 CO 3 (aq) → CO 2 (g) + H 2 O (l)
Figura \(\PageIndex{1}\)Una comparación de un padecimiento saludable con ERGE. I
mage usado con permiso (Cc BY-SA 4.0; BruceBlaus.
Bajo el nombre genérico algeldrato, el hidróxido de aluminio se utiliza como antiácido. Se prefiere el hidróxido de aluminio sobre otras alternativas como el bicarbonato de sodio porque Al (OH) 3, al ser insoluble, no aumenta el pH del estómago por encima de 7 y por lo tanto, no desencadena la secreción de exceso de ácido estomacal. Las marcas incluyen Alu-Cap, Aludrox, Gaviscon y Pepsamar. En 2016 Gaviscon fue uno de los medicamentos de venta libre de marca más vendidos en Gran Bretaña, con ventas de 62 millones de libras esterlinas. Reacciona con exceso de ácido en el estómago, reduciendo la acidez del contenido estomacal, lo que puede aliviar los síntomas de úlceras, acidez estomacal o dispepsia. Dichos productos pueden causar estreñimiento, debido a que los iones de aluminio inhiben las contracciones de las células del músculo liso en el tracto gastrointestinal, ralentizando la peristalsis y alargando el tiempo necesario para que las heces pasen por el colon. Algunos de estos productos están formulados para minimizar dichos efectos mediante la inclusión de concentraciones iguales de hidróxido de magnesio o carbonato de magnesio, los cuales tienen efectos laxantes de contrapeso.
Los antiácidos son distintos de los fármacos reductores de ácido como los antagonistas del receptor H2 o los inhibidores de la bomba de protones y no matan a la bacteria Helicobacter pylori, que causa la mayoría de las úlceras. La ranitidina (Zantac), la famotidina (Pepcid AC) y la cimetidina (Tagamet) pertenecen a una clase de medicamentos llamados bloqueadores H 2. Disminuye la cantidad de ácido que se produce en el estómago y se utilizan para tratar las úlceras; la enfermedad por reflujo gastroesofágico (ERGE), una afección en la que el flujo hacia atrás de ácido desde el estómago provoca acidez estomacal y lesiones del tubo de alimentos (esófago); y afecciones donde el estómago produce demasiado ácido, como Zollinger -Síndrome de Ellison. Estos medicamentos de venta libre se utilizan para prevenir y tratar los síntomas de acidez estomacal asociados con la indigestión ácida y el estómago agrio. El omeprazol (Prilosec) también funciona al disminuir la cantidad de ácido que se produce en el estómago y pertenece a una clase de medicamentos llamados inhibidores de la bomba de protones.
Ácidos y Bases en la Industria y en el Hogar
Ácidos Comunes
No debería ser difícil para ti nombrar varios ácidos comunes, pero es posible que encuentres que enumerar bases es solo un poco más difícil. Aquí hay una lista parcial de algunos ácidos comunes, junto con algunas fórmulas químicas:
|
Nombre del químico
|
Nombre común | Usos |
|---|---|---|
| ácido clorhídrico, HCl | ácido muriático (utilizado en piscinas) y ácido estomacal | Se utiliza en la limpieza (refinación) de metales, en el mantenimiento de piscinas, y para la limpieza del hogar. |
| ácido sulfúrico, H 2 SO 4 | Se utiliza en baterías de automóviles, y en la fabricación de fertilizantes. | |
| ácido nítrico, HNO 3 | Utilizado en la fabricación de fertilizantes, explosivos y en extracción de oro. | |
| ácido acético, HC 2 H 3 O 2 | vinagre | Ingrediente principal en vinagre. |
| ácido carbónico, H 2 CO 3 | responsable del “fiz” en bebidas carbonatadas | Como ingrediente en bebidas carbonatadas. |
| ácido cítrico, C 6 H 8 O 7 | Utilizado en alimentos y suplementos dietéticos. También se agrega como acidulante en cremas, geles, líquidos y lociones. | |
| ácido acetilsalicílico, C 6 H 4 (OCOCH 3) CO 2 H | aspirina | El ingrediente activo en la aspirina. |
Ácido clorhídrico
El ácido clorhídrico es un ácido mineral fuerte y corrosivo con muchos usos industriales. Una de las aplicaciones más importantes del ácido clorhídrico es en el decapado de acero, para eliminar óxido o incrustaciones de óxido de hierro del hierro o acero antes de su posterior procesamiento. Otro uso importante del ácido clorhídrico es en la producción de compuestos orgánicos, como el cloruro de vinilo y el dicloroetano para PVC. Otros compuestos orgánicos producidos con ácido clorhídrico incluyen bisfenol A para policarbonato, carbón activado y ácido ascórbico, así como numerosos productos farmacéuticos. Otros compuestos inorgánicos producidos con ácido clorhídrico incluyen sal de aplicación en carretera, cloruro de calcio, cloruro de níquel (II) para galvanoplastia y cloruro de zinc para la industria de galvanización y producción de baterías.
Ácido sulfúrico
El ácido sulfúrico es un producto químico muy importante, y de hecho, la producción de ácido sulfúrico de una nación es un buen indicador de su fuerza industrial. La producción mundial en el año 2004 fue de alrededor de 180 millones de toneladas, con la siguiente distribución geográfica: Asia 35%, Norteamérica (incluido México) 24%, África 11%, Europa Occidental 10%, Europa Oriental y Rusia 10%, Australia y Oceanía 7%, Sudamérica 7%. La mayor parte de esta cantidad (≈ 60%) se consume para fertilizantes, particularmente superfosfatos, fosfato de amonio y sulfatos de amonio. Alrededor del 20% se utiliza en la industria química para la producción de detergentes, resinas sintéticas, colorantes, productos farmacéuticos, catalizadores de petróleo, insecticidas y anticongelantes, así como en diversos procesos como acidificación de pozos de petróleo, reducción de aluminio, apresto de papel, tratamiento de agua. Alrededor del 6% de los usos están relacionados con pigmentos e incluyen pinturas, esmaltes, tintas de impresión, telas recubiertas y papel, y el resto se dispersa en multitud de aplicaciones como la producción de explosivos, celofán, textiles de acetato y viscosa, lubricantes, metales no ferrosos y baterías.

Debido a que la hidratación del ácido sulfúrico es termodinámicamente favorable (y es altamente exotérmica) y la afinidad del mismo por el agua es suficientemente fuerte, el ácido sulfúrico es un excelente agente deshidratante. El ácido sulfúrico concentrado tiene una propiedad deshidratante muy poderosa, eliminando el agua (\(\ce{H2O}\)) de otros compuestos incluyendo el azúcar y otros carbohidratos y produciendo carbono, calor, vapor. El ácido sulfúrico se comporta como un ácido típico en su reacción con la mayoría de los metales al generar gas hidrógeno (Ecuación\ ref {Eq1}).
Ácido nítrico
El ácido nítrico (\(\ce{HNO3}\)) es un ácido mineral altamente corrosivo y también se usa comúnmente como un agente oxidante fuerte. Normalmente se considera que el ácido nítrico es un ácido fuerte a temperatura ambiente. El principal uso industrial del ácido nítrico es para la producción de fertilizantes. El ácido nítrico se neutraliza con amoníaco para dar nitrato amónico. Esta aplicación consume entre el 75 y el 80% de los 26 millones de toneladas que se producen anualmente (1987). Las otras aplicaciones principales son para la producción de explosivos, precursores de nylon y compuestos orgánicos especiales.
|
Algunas bases comunes
|
Usos |
|---|---|
| hidróxido de sodio, NaOH (lejía o sosa cáustica) |
Se utiliza en la fabricación de jabones y detergentes y como ingrediente principal en limpiadores de hornos y desagües. |
| hidróxido de potasio, KOH (lejía o potasa cáustica) |
Utilizado en la producción de jabones líquidos y jabones blandos. Se utiliza en pilas alcalinas. |
| hidróxido de magnesio, Mg (OH) 2 (leche de magnesia) |
Se usa como ingrediente en laxantes, antiácidos y desodorantes. También se utiliza en la neutralización de aguas residuales ácidas. |
| hidróxido de calcio, Ca (OH) 2 (cal desactivada) |
Se utiliza en la fabricación de cemento y agua de cal. También, agregado para neutralizar el suelo ácido. |
| hidróxido de aluminio | Utilizado en la purificación de agua y como ingrediente en antiácidos. |
| amoníaco, NH 3 | Utilizado como un bloque de construcción para la síntesis de muchos productos farmacéuticos y en muchos productos de limpieza comerciales. Utilizado en la fabricación de fertilizantes. |
Hidróxido de Sodio
El hidróxido de sodio, también conocido como lejía y sosa cáustica, es un compuesto inorgánico con fórmula\(\ce{NaOH}\).
Es una base fuerte popular utilizada en la industria. Alrededor del 56% del hidróxido de sodio producido es utilizado por la industria, 25% del cual se utiliza en la industria papelera. El hidróxido de sodio también se utiliza en la fabricación de sales y detergentes de sodio, regulación del pH y síntesis orgánica. Se utiliza en el proceso Bayer de producción de aluminio. A granel, la mayoría de las veces se maneja como una solución acuosa, ya que las soluciones son más baratas y más fáciles de manejar.
El hidróxido de sodio se utiliza en muchos escenarios donde es deseable aumentar la alcalinidad de una mezcla, o neutralizar los ácidos.

Hidróxido de Calcio
El hidróxido de calcio (tradicionalmente llamado cal desactivada) es un compuesto inorgánico con la fórmula química\(\ce{Ca(OH)2}\). Es un cristal incoloro o polvo blanco. Tiene muchos nombres, incluyendo cal hidratada, cal cáustica, lima para constructores, lima apacada, cal o lima decapante.
Una aplicación significativa del hidróxido de calcio es como floculante, en el tratamiento de aguas y aguas residuales. También se utiliza en el tratamiento de agua dulce para elevar el pH del agua para que las tuberías no se corroan donde el agua base es ácida, porque es autorreguladora y no eleva demasiado el pH.
También se utiliza en la preparación de gas amoníaco (NH 3), utilizando la siguiente reacción:
- Ca (OH) 2 + 2NH 4 Cl → 2NH 3 + CaCl 2 + 2H 2 O
Otra gran aplicación es en la industria papelera, donde es un intermedio en la reacción en la producción de hidróxido de sodio. Debido a su baja toxicidad y la suavidad de sus propiedades básicas, la cal ahumada es ampliamente utilizada en la industria alimentaria:
Amoníaco
El amoníaco es un compuesto de nitrógeno e hidrógeno con la fórmula\(\ce{NH3}\) y es un gas incoloro con un olor acre característico. Es el producto activo de las “sales olorosas”, y puede revivir rápidamente los débiles de corazón y la luz de la cabeza. Aunque es común en la naturaleza y en uso amplio, el amoníaco es a la vez cáustico y peligroso en su forma concentrada.
A nivel mundial, aproximadamente 88% (a partir de 2014) del amoníaco se utiliza como fertilizantes ya sea como sus sales, soluciones o anhidrousamente. Cuando se aplica al suelo, ayuda a proporcionar mayores rendimientos de cultivos como el maíz y el trigo. El 30% del nitrógeno agrícola aplicado en EU es en forma de amoníaco anhidro y en todo el mundo se aplican 110 millones de toneladas cada año. El amoníaco también es un bloque de construcción para la síntesis de muchos productos farmacéuticos y se utiliza en muchos productos de limpieza comerciales.
Resumen
Los ácidos y bases comunes tienen muchos y diversos usos en la industria y en la vida diaria.
Colaboradores y Atribuciones
CK-12 Foundation by Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson, and Jean Dupon.
Peggy Lawson (Oxbow Prairie Heights School). Funded by Saskatchewan Educational Technology Consortium.
- Wikipedia
- TextMap: Chemistry-A Molecular Approach (Tro)
Henry Agnew (UC Davis)
- MedlinePlus

