8.1: Oxidación y Reducción - Cuatro Vistas
- Page ID
- 72314
- Definir oxidación y reducción.
- Asignar números de oxidación a átomos en compuestos simples.
- Reconocer una reacción como una reacción de oxidación-reducción.
El oxígeno es un elemento que se conoce desde hace siglos. En su forma elemental pura, el oxígeno es altamente reactivo, y produce fácilmente compuestos con la mayoría de los demás elementos. También es el elemento más abundante por masa en la corteza terrestre. La clase de reacciones llamadas oxidación y reducción se definieron originalmente con respecto al elemento oxígeno.
Muchos elementos simplemente se combinan con el oxígeno para formar el óxido de ese elemento. Calentar el magnesio en el aire le permite combinarse con el oxígeno para formar óxido de magnesio.
\[2 \ce{Mg} \left( s \right) + \ce{O_2} \left( g \right) \rightarrow 2 \ce{MgO} \left( s \right) \nonumber \]
Muchos compuestos también reaccionan con el oxígeno, a menudo en procesos muy exotérmicos que generalmente se denominan reacciones de combustión. Por ejemplo, cuando se quema metano, se produce dióxido de carbono y agua.
\[\ce{CH_4} \left( g \right) + 2 \ce{O_2} \left( g \right) \rightarrow \ce{CO_2} \left( g \right) + 2 \ce{H_2O} \left( g \right) \nonumber \]
El dióxido de carbono es un óxido de carbono, mientras que el agua es un óxido de hidrógeno. Los primeros científicos vieron la oxidación como un proceso en el que una sustancia reaccionaba con oxígeno para producir uno o más óxidos. En los ejemplos anteriores, el magnesio y el metano están siendo oxidados.
Las definiciones de oxidación y reducción finalmente se ampliaron para incluir tipos similares de reacciones que no necesariamente involucran oxígeno. El oxígeno es más electronegativo que cualquier elemento excepto el flúor. Por lo tanto, cuando el oxígeno está unido a cualquier elemento que no sea flúor, los electrones del otro átomo se desplazan alejándose de ese átomo y hacia el átomo de oxígeno. Una reacción de oxidación-reducción (a veces abreviada como reacción redox) es una reacción que implica la transferencia total o parcial de electrones de un reactivo a otro. La oxidación implica una pérdida total o parcial de electrones, mientras que la reducción implica una ganancia total o parcial de electrones.
Las reacciones redox requieren que hagamos un seguimiento de los electrones asignados a cada átomo en una reacción química. ¿Cómo lo hacemos? Utilizamos números de oxidación para realizar un seguimiento de los electrones en los átomos. Los números de oxidación se asignan a los átomos en base a cuatro reglas. Los números de oxidación no son necesariamente iguales a la carga en el átomo (aunque a veces pueden serlo); debemos mantener separados los conceptos de carga y números de oxidación.
Asignación de números de oxidación
El número de oxidación es un número positivo o negativo que se le asigna a un átomo para indicar su grado de oxidación o reducción. En los procesos de oxidación-reducción, la fuerza impulsora del cambio químico está en el intercambio de electrones entre especies químicas. Se han desarrollado una serie de reglas para ayudarnos.
Las reglas para asignar números de oxidación a átomos son las siguientes:
- A los átomos en su estado elemental se les asigna un número de oxidación de 0.
Ejemplos:\(\ce{H_2}\),,\(\ce{Br_2}\),\(\ce{Na}\),\(\ce{Be}\),\(\ce{K}\),\(\ce{O_2}\),\(\ce{P_4}\), todos tienen un número de oxidación de 0. - A los átomos en iones monatómicos (es decir, de un átomo) se les asigna un número de oxidación igual a su carga.
Ejemplo: En MgCl 2, el magnesio tiene un número de oxidación de +2, mientras que cada átomo de cloro tiene un número de oxidación de -1 - En los compuestos, al flúor se le asigna un número de oxidación −1; al oxígeno generalmente se le asigna un número de oxidación −2 [excepto en los compuestos de peróxido (donde es −1) y en compuestos binarios con flúor (donde es positivo)]; y al hidrógeno se le asigna generalmente un número de oxidación +1 [excepto cuando existe como ión hidruro (H −), en cuyo caso prevalece la regla 2].
Ejemplo: En H 2 O, los átomos de H tienen cada uno un número de oxidación de +1, mientras que el átomo de O tiene un número de oxidación de −2, aunque el hidrógeno y el oxígeno no existen como iones en este compuesto. - En los compuestos, a todos los demás átomos se les asigna un número de oxidación para que la suma de los números de oxidación en todos los átomos de la especie sea igual a la carga sobre la especie (que es cero si la especie es neutra).
Ejemplo: En SO 2. Cada átomo de O tiene un número de oxidación de −2; para que la suma de los números de oxidación sea igual a la carga en la especie (que es cero), al átomo de S se le asigna un número de oxidación de +4. ¿Significa esto que el átomo de azufre tiene una carga 4+ en él? No, solo significa que al átomo S se le asigna un número de oxidación +4 por nuestras reglas de reparto de electrones entre los átomos en un compuesto.
Los números de oxidación suelen escribirse con el signo primero, luego la magnitud, para diferenciarlos de las cargas.
Asignar números de oxidación a los átomos en cada sustancia.
- Cl 2
- GeO 2
- CaCl 2
Solución
- Cl 2 es la forma elemental del cloro. La regla 1 establece que cada átomo tiene un número de oxidación de 0.
- Por regla 3, al oxígeno se le asigna normalmente un número de oxidación de −2. Para que la suma de los números de oxidación sea igual a la carga en la especie (cero), al átomo de Ge se le asigna un número de oxidación de +4.
- El ion Ca 2 + tiene un número de oxidación de +2 por regla 2. También de acuerdo con la regla 2, a cada átomo de cloro se le asigna un número de oxidación de −1.
Asignar números de oxidación a los átomos en H 3 PO 4.
- Contestar
-
H: +1; O: −2; P: +5
Reacciones de oxidación y reducción
Los procesos de oxidación y reducción se ven comúnmente en términos de ganancia o pérdida de electrones o el aumento o disminución de los números de oxidación. Sin embargo, muchas reacciones en química orgánica que implican la ganancia o pérdida de oxígeno o hidrógeno también se consideran como reacciones redox.
En la siguiente tabla se resumen los procesos de oxidación y reducción.
| Oxidación | R ed uction |
|---|---|
| Pérdida completa de electrones (reacción iónica) | Ganancia completa de electrones (reacción iónica) |
| Incremento en el número de oxidación | Disminución del número de oxidación |
| Ganancia de oxígeno | Pérdida de oxígeno |
| Pérdida de hidrógeno en un compuesto molecular | Ganancia de hidrógeno en un compuesto molecular |
1. La oxidación es la pérdida completa de electrones. La reducción es ganancia completa de electrones
Para entender las reacciones de transferencia de electrones como la que existe entre el metal zinc y los iones hidrógeno, los químicos los separan en dos partes: una parte se centra en la pérdida de electrones y una parte se centra en la ganancia de electrones. La pérdida de electrones se llama oxidación. La ganancia de electrones se llama reducción.
Los electrones que se pierden se escriben como productos; los electrones que se ganan se escriben como reactivos. Por ejemplo, la reacción a continuación representa cuando se agrega ácido al metal zinc.
\[\ce{Zn (s) + 2H^{+} (aq) → Zn^{2+}(aq) + H2(g)} \nonumber \]
los átomos de zinc se oxidan a Zn 2 +. La media reacción para la reacción de oxidación, omitiendo las marcas de fase, es la siguiente:
\[\ce{Zn → Zn^{2+} + 2e^{−}} \nonumber \]
Esta media reacción se equilibra en términos del número de átomos de zinc, y también muestra los dos electrones que se necesitan como productos para dar cuenta de que el átomo de zinc pierde dos cargas negativas para convertirse en un ion 2+. Con medias reacciones, hay un elemento más para equilibrar: la carga general en cada lado de la reacción. Si revisas cada lado de esta reacción, notarás que ambos lados tienen una carga neta cero.
El hidrógeno se reduce en la reacción. La media reacción de reducción equilibrada es la siguiente:
\[\ce{2H^{+} + 2e^{−} → H2} \nonumber \]
Hay dos átomos de hidrógeno en cada lado, y los dos electrones escritos como reactivos sirven para neutralizar la carga 2+ en los iones de hidrógeno reaccionantes. Nuevamente, la carga general en ambos lados es cero.
LEO significa Perder electrones es oxidación, mientras que GER significa Ganar electrones es reducción.

Este tipo conoce sus reacciones redox.
2. La oxidación es un incremento en el número de oxidación. La reducción es una disminución en el número de oxidación.
Considere la siguiente reacción entre el hierro elemental y el sulfato de cobre:
\[\ce{Fe} + \ce{CuSO_4} \rightarrow \ce{FeSO_4} + \ce{Cu} \nonumber \]
En el transcurso de la reacción, el número de oxidación de\(\ce{Fe}\) aumenta de cero a\(+2\). El número de oxidación del cobre disminuye de\(+2\) a\(0\). Este resultado está de acuerdo con la serie de actividades. El hierro está por encima del cobre en la serie, por lo que será más probable que se forme\(\ce{Fe^{2+}}\) mientras se convierte el\(\ce{Cu^{2+}}\) cobre metálico\(\left( \ce{Cu^0} \right)\).
3. La oxidación es ganancia de oxígeno. La reducción es la pérdida de oxígeno.
La oxidación y reducción también se pueden definir en términos de cambios en la composición. El significado original de oxidación era “agregar oxígeno”, por lo que cuando se agrega oxígeno a una molécula, la molécula se está oxidando. Lo contrario es cierto para la reducción: si una molécula pierde átomos de oxígeno, la molécula se está reduciendo. Por ejemplo, la molécula de acetaldehído (\(CH3CHO\)) toma un átomo de oxígeno para convertirse en ácido acético (\(\ce{CH3COOH}\)).
\[\ce{2CH3CHO + O2 → 2CH_3COOH} \nonumber \]
Así, el acetaldehído está siendo oxidado.
4. La oxidación es la pérdida de hidrógeno en un compuesto molecular. La reducción es la ganancia de hidrógeno en un compuesto molecular.
La oxidación y reducción pueden definirse en términos de ganancia o pérdida de átomos de hidrógeno. Si una molécula agrega átomos de hidrógeno, se está reduciendo. Si una molécula pierde átomos de hidrógeno, la molécula está siendo oxidada. Por ejemplo, en la conversión de acetaldehído en etanol CH 3 CHO, se agregan átomos de hidrógeno al acetaldehído, por lo que el acetaldehído se está reduciendo:
\[\ce{CH3CHO + H2 → CH3CH2OH} \nonumber \]
En cada conversión, indicar si se está produciendo oxidación o reducción.
- N 2 → NH 3
- CH 3 CH 2 OHCH 3 → CH 3 COCH 3
- HCHO → HCOOH
Solución
- Se está agregando hidrógeno a la molécula reaccionante original, por lo que se está produciendo una reducción.
- El hidrógeno se está eliminando de la molécula reaccionante original, por lo que se está produciendo la oxidación.
- Se está agregando oxígeno a la molécula reaccionante original, por lo que se está produciendo la oxidación.
En cada conversión, indicar si se está produciendo oxidación o reducción.
- CH 4 → CO 2 + H 2 O
- NO 2 → N 2
- CH 2 =CH 2 → CH 3 CH 3
RESPUESTAS
- oxidación
- reducción
- reducción
Identificar lo que se está oxidando y reduciendo en esta reacción redox.
\[\ce{2Na + Br2 → 2NaBr} \nonumber \]Solución
Ambos reactivos son las formas elementales de sus átomos, por lo que los átomos de Na y Br tienen números de oxidación de 0. En el producto iónico, los iones Na + tienen un número de oxidación de +1, mientras que los iones Br − tienen un número de oxidación de −1.
\[2\underset{0}{Na}+\underset{0}{Br_{2}}\rightarrow 2\underset{+1 -1}{NaBr} \nonumber \]
El sodio está aumentando su número de oxidación de 0 a +1, por lo que se está oxidando; el bromo está disminuyendo su número de oxidación de 0 a −1, por lo que se está reduciendo:
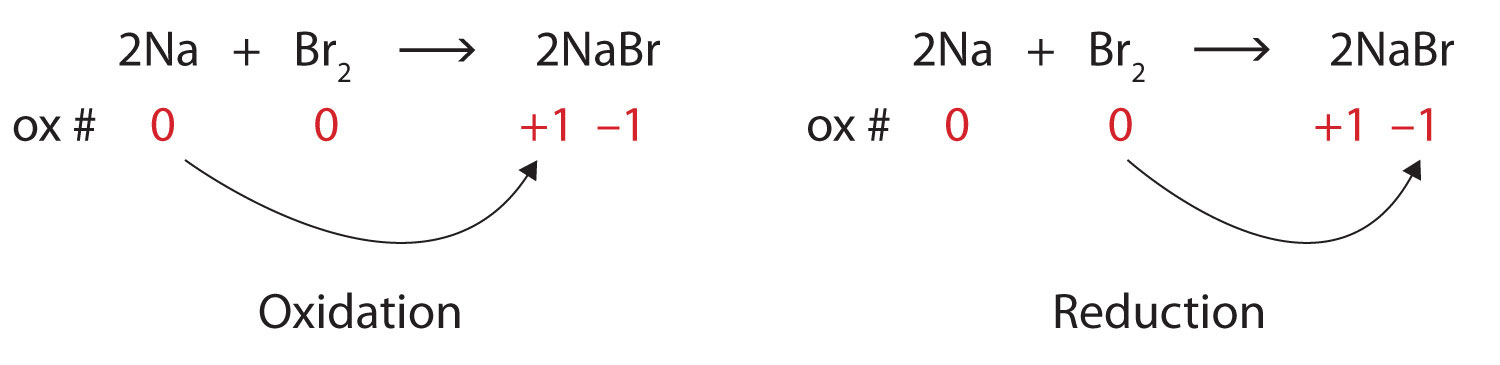
Debido a que los números de oxidación están cambiando, esta es una reacción redox. El número total de electrones que se pierden por el sodio (dos, uno perdido de cada átomo de Na) es ganado por el bromo (dos, uno ganado por cada átomo de Br).
Identificar lo que se está oxidando y reduciendo en esta reacción redox.
\[\ce{C + O2 → CO2}\nonumber \]
- Contestar
-
C está siendo oxidado de 0 a +4; O se está reduciendo de 0 a −2.
Por cada media reacción, identificar si hubo una pérdida o ganancia de electrones.
- 2N 3 - → N 2
- Cr 6 + → Cr 3 +
Soluciones
a. cuando comparamos las cargas generales en cada lado de la ecuación, encontramos una carga de 2 (-3) =-6 a la izquierda pero una carga de 0 a la derecha. Esta ecuación no está debidamente equilibrada. Para equilibrarlo, se deben agregar seis electrones en el lado derecho de la siguiente manera:
\ [\ ce {2N^ {3-} → N2 + 6e^ {-}}\ nonumber\]
Entonces hubo una pérdida de seis electrones. Ahora la ecuación está equilibrada, no sólo en términos de elementos sino también en términos de carga.
b. Cuando comparamos las cargas generales en cada lado de la ecuación, encontramos una carga de +6 a la izquierda y una carga de +3 a la derecha. Esta ecuación no está debidamente equilibrada. Para terminar con un número de oxidación de +3 en el lado derecho se deben agregar 3 electrones en el lado izquierdo de la siguiente manera:
\ [\ ce {Cr^ {6+} + 3e^ {-} → Cr^ {3+}\ nonúmero\]
Entonces hubo una ganancia de tres electrones. Ahora la ecuación está equilibrada en términos de carga.
Por cada media reacción, identificar si hubo una pérdida o ganancia de electrones.
- O 2 → 2O 2 -
- Cu + → Cu 2 +
RESPUESTAS
a. ganancia de cuatro electrones
b. pérdida de un electrón
Escribe y equilibra la reacción redox que tiene iones plata y aluminio metal como reactivos e iones plata metal y aluminio como productos.
Solución
Comenzamos usando símbolos de los elementos e iones para representar la reacción:
\[\ce{Ag^{+} + Al → Ag + Al^{3+}} \nonumber \]
La ecuación se ve equilibrada tal como está escrita. Sin embargo, cuando comparamos las cargas generales en cada lado de la ecuación, encontramos una carga de +1 a la izquierda pero una carga de +3 a la derecha. Esta ecuación no está debidamente equilibrada. Para equilibrarlo, escribamos las dos medias reacciones. Los iones de plata se reducen, y se necesita un electrón para cambiar Ag + a Ag:
\[\ce{Ag^{+} + e^{−} → Ag} \nonumber \]
El aluminio se oxida, perdiendo tres electrones para cambiar de Al a Al 3 +:
\[\ce{Al → Al^{3+} + 3e^{−}} \nonumber \]
Para combinar estas dos medias reacciones y cancelar todos los electrones, necesitamos multiplicar la reacción de reducción de plata por 3:
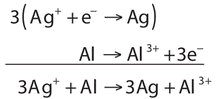
Ahora la ecuación está equilibrada, no sólo en términos de elementos sino también en términos de carga.
Escribe y equilibra la reacción redox que tiene iones calcio y potasio metal como reactivos y iones calcio metal y potasio como productos.
Resumen
- Se listan las reglas para determinar los números de oxidación.
- Se proporcionan ejemplos de determinaciones del número de oxidación.
- Las reacciones químicas en las que se transfieren electrones se denominan reacciones de oxidación-reducción, o redox.
- La oxidación se define en términos de pérdida de electrones, ganancia de oxígeno, pérdida de hidrógeno o aumento en el número de oxidación.
- La reducción se define en términos de ganancia de electrones, pérdida de oxígeno, ganancia de hidrógeno o disminución en el número de oxidación.
- La oxidación y la reducción siempre ocurren juntas, aunque pueden escribirse como ecuaciones químicas separadas.
Colaboradores y Atribuciones
CK-12 Foundation by Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson, and Jean Dupon.
- Libretext: Beginning Chemistry (Ball et al.)
- Libretext: The Basics of GOB Chemistry (Ball et al.)
- Libretext: Chemistry for Allied Health (Soult)
Ed Vitz (Kutztown University), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (University of Minnesota Rochester), Tim Wendorff, and Adam Hahn.

