8.2: Agentes Oxidantes y Reductores
- Page ID
- 72299
- Identificar agentes oxidantes y reductores.
La vida en el planeta Tierra es un conjunto complicado y bien organizado de procesos. Los animales están diseñados para respirar oxígeno y las plantas están diseñadas para producir oxígeno. La fotosíntesis es el medio por el cual obtenemos el oxígeno que necesitamos para la vida. La luz que incide en un pigmento vegetal conocido como clorofila inicia una compleja serie de reacciones, muchas de las cuales involucran procesos redox completos con movimiento de electrones. En esta serie de reacciones, el agua se convierte en gas oxígeno, y tenemos algo para sostener nuestras vidas.
La siguiente reacción es una reacción redox que produce sulfuro de zinc:
\[\ce{Zn} + \ce{S} \rightarrow \ce{ZnS}\nonumber \]
Las medias reacciones se pueden escribir:
\[\begin{align*} &\text{Oxidation:} \: \ce{Zn} \rightarrow \ce{Zn^{2+}} + 2 \ce{e^-} \\ &\text{Reduction:} \: \ce{S} + 2 \ce{e^-} \rightarrow \ce{S^{2-}} \end{align*} \nonumber \]
En la reacción anterior, el zinc se está oxidando al perder electrones. No obstante, debe haber otra sustancia presente que gane esos electrones y en este caso esa es el azufre. En otras palabras, el azufre está provocando que el zinc sea oxidado. El azufre se llama el agente oxidante. El zinc hace que el azufre gane electrones y se reduzca y así el zinc se llama el agente reductor. El agente oxidante es una sustancia que provoca oxidación al aceptar electrones; por lo tanto, su estado de oxidación disminuye. El agente reductor es una sustancia que provoca la reducción al perder electrones; por lo tanto su estado de oxidación aumenta. La forma más sencilla de pensar en esto es que el agente oxidante es la sustancia que se reduce, mientras que el agente reductor es la sustancia que se oxida como se muestra en la Figura\(\PageIndex{1}\) y se resume en la Tabla\(\PageIndex{1}\).
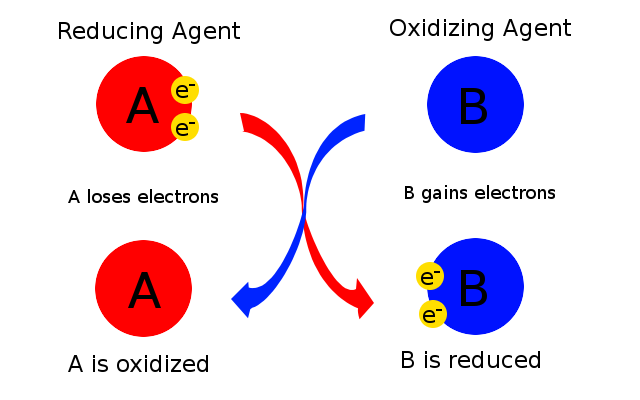
Tanto los agentes oxidantes como los reductores son los reactivos y por lo tanto aparecen en el lado izquierdo de una ecuación.
| Agentes Oxidantes | Agentes Reductores | |
|---|---|---|
| Estado de Oxidación | Disminuye | Incrementa |
| # de Electrones | Ganado | Perdidos |
| Sustancia es... | Reducida | Oxidado |
Los siguientes ejemplos muestran cómo analizar una reacción redox e identificar agentes oxidantes y reductores.
Cuando se burbujea gas cloro en una solución de bromuro de sodio, se produce una reacción que produce cloruro de sodio acuoso y bromo. Determinar qué se está oxidando y qué se está reduciendo. Identificar los agentes oxidantes y reductores.
\[\ce{Cl_2} \left( g \right) + 2 \ce{NaBr} \left( aq \right) \rightarrow 2 \ce{NaCl} \left( aq \right) + \ce{Br_2} \left( l \right) \nonumber \]
Solución:
Paso 1: Planear el problema.
Descomponer la reacción en una ecuación iónica neta y luego en medias reacciones. La sustancia que pierde electrones está siendo oxidada y es el agente reductor. La sustancia que gana electrones se está reduciendo y es el agente oxidante.
Paso 2: Resolver.
\[\begin{align*} \ce{Cl_2} \left( g \right) + \cancel{2 \ce{Na^+} \left( aq \right)} + 2 \ce{Br^-} \left( aq \right) &\rightarrow \cancel{2 \ce{Na^+} \left( aq \right)} + 2 \ce{Cl^-} \left( aq \right) + \ce{Br_2} \left( l \right) \\ \ce{Cl_2} \left( g \right) + 2 \ce{Br^-} \left( aq \right) &\rightarrow 2 \ce{Cl^-} \left( aq \right) + \ce{Br_2} \left(l \right) \: \: \: \: \: \left( \text{net ionic equation} \right) \end{align*} \nonumber \]
\[\begin{align*} &\text{Reduction:} \: \ce{Cl_2} \left( g \right) + 2 \ce{e^-} \rightarrow 2 \ce{Cl^-} \left( aq \right) \\ &\text{Oxidation:} \: 2 \ce{Br^-} \left( aq \right) \rightarrow \ce{Br_2} \left( l \right) + 2 \ce{e^-} \end{align*} \nonumber \]
El\(\ce{Cl_2}\) se está reduciendo y es el agente oxidante. El\(\ce{Br^-}\) está siendo oxidado y es el agente reductor.
Escribe la siguiente reacción en forma de medias ecuaciones. Identificar cada media ecuación como una oxidación o una reducción. Identificar también el agente oxidante y el agente reductor en la reacción general
\[\ce{Zn + 2Fe^{3+} -> Zn^{2+} +2Fe^{2+}} \nonumber \nonumber \]
Contestar
Las medias ecuaciones son
\(\ce{Zn -> Zn^{2+} + 2e^{-}}\)oxidación—pérdida de electrones
\(\ce{2e^{-} + 2Fe^{3+} -> 2Fe^{2+}}\)reducción—ganancia de electrones
El zinc se ha oxidado, el agente oxidante debe haber sido el otro reactivo, es decir, el hierro (III).
Se ha reducido el ion hierro (III), el zinc debe ser el agente reductor.
Identificar los agentes reductores y oxidantes en la reacción redox equilibrada:
\[ Cl_2 (aq) + 2Br^- (aq) \rightarrow 2Cl^- (aq) + Br_2 (aq)\nonumber \]
Media reacción de oxidación
\[2 Br^- (aq) \rightarrow Br_2 (aq)\nonumber \]
Estados de oxidación: -1 a 0
Media reacción de reducción
\[Cl_2 (aq) \rightarrow 2 Cl^- (aq)\nonumber \]
Estados de oxidación: 0 a -1
Visión general
- Br - pierde un electrón; se oxida de Br - a Br 2; así, Br - es el agente reductor.
- Cl 2 gana un electrón; se reduce de Cl 2 a 2 Cl -; así, Cl 2 es el agente oxidante.
Identificar el agente oxidante y el agente reductor en la siguiente reacción redox:
\[MnO_4^- + SO_3^{2-} \rightarrow Mn^{2+} + SO_4^{2-}\nonumber \]
Solución
\(S\)es el agente reductor y\(Mn\) es el agente oxidante.
Resumen
- Un agente oxidante es una sustancia que provoca oxidación al aceptar electrones; por lo tanto, se reduce.
- Un agente reductor es una sustancia que provoca la reducción al perder electrones; por lo tanto, se oxida.
- Se muestran ejemplos de cómo identificar agentes oxidantes y reductores.
Colaboradores y Atribuciones
CK-12 Foundation by Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson, and Jean Dupon.
Ed Vitz (Kutztown University), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (University of Minnesota Rochester), Tim Wendorff, and Adam Hahn.
- Diana Pearson, Connie Xu, Luvleen Brar (UCD)

