8.5: Oxígeno - Un agente oxidante abundante y esencial
- Page ID
- 72315
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)- Conocer la ocurrencia y propiedades del oxígeno.
- Conocer reacciones que involucren al oxígeno como agente oxidante.
El oxígeno elemental es un agente oxidante fuerte. Reacciona con la mayoría de los otros elementos y muchos compuestos. El oxígeno fue aislado por Michael Sendivogius antes de 1604, pero comúnmente se cree que el elemento fue descubierto independientemente por Carl Wilhelm Scheele, en Uppsala, en 1773 o antes, y Joseph Priestley en Wiltshire, en 1774. El nombre oxígeno fue acuñado en 1777 por Antoine Lavoisier, quien primero reconoció al oxígeno como un elemento químico y caracterizó correctamente el papel que juega en la combustión.
Oxígeno: Ocurrencia y Propiedades
Por masa, el oxígeno es el tercer elemento más abundante del universo, después del hidrógeno y el helio. El oxígeno es el elemento más abundante en la corteza terrestre. Alrededor del 50% de la masa de la corteza terrestre consiste en oxígeno (combinado con otros elementos, principalmente silicio). El oxígeno se presenta como moléculas de O 2 y, en cierta medida, como moléculas de O 3 (ozono) en el aire. Forma alrededor del 20% de la masa del aire. Alrededor del 89% del agua en masa consiste en oxígeno combinado. En combinación con carbono, hidrógeno y nitrógeno, el oxígeno es una gran parte de las plantas y los animales.
El oxígeno es un gas incoloro, inodoro e insípido a temperaturas normales. Es un poco más denso que el aire. Aunque solo es ligeramente soluble en agua (49 mL de gas se disuelve en 1 L en STP), la solubilidad del oxígeno es muy importante para la vida acuática.
El oxígeno es esencial en procesos de combustión como la quema de combustibles. Todas las reacciones de combustión son también ejemplos de reacciones redox. Una reacción de combustión ocurre cuando una sustancia reacciona con el oxígeno para crear calor. Un ejemplo es la combustión del octano, el componente principal de la gasolina:
\[\ce{2 C_8H_{18} (l) + 25 O_2 (g) -> 16 CO_2 (g) + 18 H_2O (g) } \nonumber \]
Las reacciones de combustión son una fuente importante de energía para la industria moderna. Las plantas y los animales utilizan el oxígeno del aire en la respiración. La administración de aire enriquecido con oxígeno es una práctica médica importante cuando un paciente recibe un suministro inadecuado de oxígeno por choque, neumonía o alguna otra enfermedad.
La industria química emplea oxígeno para oxidar muchas sustancias. Una cantidad significativa de oxígeno producido comercialmente es importante en la eliminación de carbono del hierro durante la producción de acero. También son necesarias grandes cantidades de oxígeno puro en la fabricación de metales y en el corte y soldadura de metales con sopletes de oxihidrógeno y oxiacetileno. El oxígeno líquido es importante para la industria espacial. Es un agente oxidante en motores de cohetes. También es la fuente de oxígeno gaseoso para soporte vital en el espacio.
Como sabemos, el oxígeno es muy importante para la vida. La energía requerida para el mantenimiento de las funciones normales del cuerpo en seres humanos y en otros organismos proviene de la lenta oxidación de compuestos químicos. El oxígeno es el agente oxidante final en estas reacciones. En los humanos, el oxígeno pasa de los pulmones a la sangre, donde se combina con la hemoglobina, produciendo oxihemoglobina. De esta forma, la sangre transporta el oxígeno a los tejidos, donde se transfiere a los tejidos. Los productos definitivos son el dióxido de carbono y el agua. La sangre transporta el dióxido de carbono a través de las venas hasta los pulmones, donde la sangre libera el dióxido de carbono y recoge otro suministro de oxígeno. La digestión y asimilación de los alimentos regeneran los materiales consumidos por la oxidación en el cuerpo; la energía liberada es la misma que si el alimento se quemara fuera del cuerpo.
Oxígeno: reacciones con otros elementos
El oxígeno reacciona directamente a temperatura ambiente o a temperaturas elevadas con todos los demás elementos excepto los gases nobles, los halógenos y pocos metales de transición de segunda y tercera fila de baja reactividad (aquellos con mayores potenciales de reducción que el cobre). La roya es un ejemplo de la reacción del oxígeno con el hierro. Los metales más activos forman peróxidos o superóxidos. Los metales menos activos y los no metales dan óxidos. Dos ejemplos de estas reacciones son:
\[\ce{2Mg (s) + O2(g) -> 2MgO(s)} \nonumber \]
\[\ce{P4(s)+ 5O2 (g) -> P4O10(s)} \nonumber \]
Los óxidos de halógenos, al menos uno de los gases nobles, y metales con mayores potenciales de reducción que el cobre no se forman por la acción directa de los elementos con el oxígeno.
Oxígeno: Reacción con Compuestos
El oxígeno elemental también reacciona con algunos compuestos. Si es posible oxidar alguno de los elementos en un compuesto dado, puede ocurrir una oxidación adicional por oxígeno. Por ejemplo, sulfuro de hidrógeno, H 2 S, contiene azufre con un estado de oxidación de 2−. Debido a que el azufre no presenta su estado máximo de oxidación, esperaríamos que H 2 S reaccione con el oxígeno. Lo hace, dando agua y dióxido de azufre. La reacción es:
\[\ce{2H2S}(g)+\ce{3O2}(g)⟶\ce{2H2O}(l)+\ce{2SO2}(g) \nonumber \]
También es posible oxidar óxidos como CO y P 4 O 6 que contienen un elemento con un estado de oxidación inferior. La facilidad con la que el oxígeno elemental recoge electrones se ve reflejada por la dificultad de eliminar electrones del oxígeno en la mayoría de los óxidos. De los elementos, solo el flúor muy reactivo puede oxidar óxidos para formar gas oxígeno.
La mayoría de los no metales reaccionan con el oxígeno para formar óxidos no metálicos. Dependiendo de los estados de oxidación disponibles para el elemento, se pueden formar una variedad de óxidos. El flúor se combinará con el oxígeno para formar fluoruros como el OF 2, donde el oxígeno tiene un estado 2+-oxidación.
Compuestos de oxígeno de azufre
Los dos óxidos comunes de azufre son dióxido de azufre, SO 2, y trióxido de azufre, SO 3. El olor a azufre ardiente proviene del dióxido de azufre. El dióxido de azufre, se presenta en los gases volcánicos Figura\(\PageIndex{1}\) y en la atmósfera cerca de plantas industriales que queman combustibles que contienen compuestos de azufre.

Ozono: Otra forma de oxígeno
Cuando se hace pasar oxígeno seco entre dos placas cargadas eléctricamente, se forma ozono (O 3, ilustrado en la Figura\(\PageIndex{2}\)), un alótropo de oxígeno que posee un olor distintivo. La formación de ozono a partir del oxígeno es una reacción endotérmica, en la que la energía proviene de una descarga eléctrica, calor o luz ultravioleta:
\[\ce{3O2}(g)\xrightarrow{\ce{electric\: discharge}}\ce{2O3}(g) \nonumber \]
El fuerte olor asociado con chispas de equipos eléctricos se debe, en parte, al ozono.
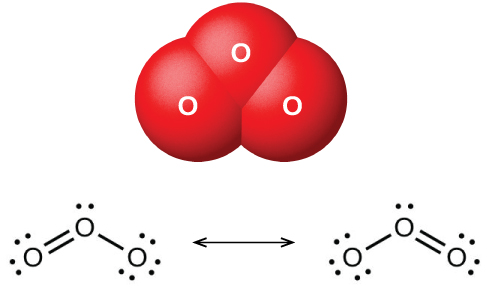
El ozono se forma naturalmente en la atmósfera superior por la acción de la luz ultravioleta del sol sobre el oxígeno allí. La mayor parte del ozono atmosférico ocurre en la estratosfera, una capa de la atmósfera que se extiende de aproximadamente 10 a 50 kilómetros por encima de la superficie terrestre. Este ozono actúa como barrera a la luz ultravioleta dañina del sol al absorberla a través de una reacción de descomposición química:
\[\ce{O3}(g)\xrightarrow{\ce{ultraviolet\: light}}\ce{O}(g)+\ce{O2}(g) \nonumber \]
Los átomos de oxígeno reactivos se recombinan con oxígeno molecular para completar el ciclo del ozono. La presencia de ozono estratosférico disminuye la frecuencia de cáncer de piel y otros efectos dañinos de la radiación ultravioleta. Se ha demostrado claramente que los clorofluorocarbonos, los CFC (conocidos comercialmente como Freones), que estuvieron presentes como propelentes de aerosol en latas de aerosol y como refrigerantes, causaron el agotamiento del ozono en la estratosfera. Esto ocurrió porque la luz ultravioleta también hace que los CFC se descompongan, produciendo cloro atómico. Los átomos de cloro reaccionan con las moléculas de ozono, lo que resulta en una eliminación neta de moléculas de O 3 de la estratosfera. Este proceso se explora en detalle en nuestra cobertura de cinética química. Hay un esfuerzo mundial para reducir la cantidad de CFC utilizados comercialmente, y el agujero de ozono ya está comenzando a disminuir de tamaño a medida que disminuyen las concentraciones atmosféricas de cloro atómico. Si bien el ozono en la estratosfera nos ayuda a protegernos, el ozono en la troposfera es un problema. Este ozono es un componente tóxico del smog fotoquímico.
Los usos del ozono dependen de su reactividad con otras sustancias. Se puede utilizar como agente blanqueador para aceites, ceras, telas y almidón: Oxida los compuestos coloreados en estas sustancias a compuestos incoloros. Es una alternativa al cloro como desinfectante para el agua.
El ozono de bajo nivel (o ozono troposférico) es un contaminante atmosférico. [42] No es emitido directamente por motores de automóviles ni por operaciones industriales, sino que se forma por la reacción de la luz solar sobre el aire que contiene hidrocarburos y óxidos de nitrógeno que reaccionan para formar ozono directamente en la fuente de la contaminación o muchos kilómetros abajo viento.
El ozono reacciona directamente con algunos hidrocarburos como los aldehídos y así comienza su eliminación del aire, pero los productos son en sí mismos componentes clave del smog.
El ozono se puede utilizar para eliminar hierro y manganeso del agua, formando un precipitado que se puede filtrar:
\[2 Fe^{2+} + O_3 + 5 H_2O → 2 Fe(OH)_3(s) + O_2 + 4 H^+ \nonumber \]
\[2 Mn^{2+} + 2 O_3 + 4 H_2O → 2 MnO(OH)_2(s) + 2 O_2 + 4 H^+ \nonumber \]
El ozono también oxidará el sulfuro de hidrógeno disuelto en agua a ácido sulfuroso:
\[3 O_3 + H_2S → H_2SO_3 + 3 O_2 \nonumber \]
Estas tres reacciones son centrales en el uso del tratamiento de agua de pozo a base de ozono.
El ozono también desintoxicará los cianuros convirtiéndolos en cianatos.
\[CN^− + O_3 → CNO^− + O_2 \nonumber \]
El ozono también descompondrá completamente la urea:
\[(NH_2)_2CO + O_3 → N_2 + CO_2 + 2 H_2O \nonumber \]
Otros Agentes Oxidantes Comunes
El cloro se usa generalmente (en forma de ácido hipocloroso) para matar bacterias y otros microbios en los suministros de agua potable y piscinas públicas. En la mayoría de las piscinas privadas no se usa cloro en sí, sino hipoclorito de sodio, formado a partir de cloro e hidróxido de sodio, o tabletas sólidas de isocianuratos clorados. El inconveniente de usar cloro en piscinas es que el cloro reacciona con las proteínas en el cabello y la piel humanos. El distintivo 'cloro aroma' asociado a las piscinas no es el resultado del cloro en sí, sino de la cloramina, un compuesto químico producido por la reacción del cloro libre disuelto con aminas en sustancias orgánicas. Como desinfectante en agua, el cloro es más de tres veces más efectivo contra Escherichia coli que el bromo, y más de seis veces más efectivo que el yodo. Cada vez más, la cloramina misma se agrega directamente al agua potable para fines de desinfección, un proceso conocido como cloraminación.
A menudo no es práctico almacenar y usar gas de cloro venenoso para el tratamiento del agua, por lo que se utilizan métodos alternativos para agregar cloro. Estas incluyen soluciones de hipoclorito, que gradualmente liberan cloro en el agua, y compuestos como dicloro-s-triazinetriona sódica (dihidratada o anhidra), a veces denominada “diclor”, y tricloro-s-triazinetriona, a veces denominada “tricloro”. Estos compuestos son estables mientras son sólidos y se pueden usar en forma de polvo, granular o comprimido. Cuando se agregan en pequeñas cantidades al agua de la piscina o a los sistemas de agua industriales, los átomos de cloro se hidrolizan del resto de la molécula formando ácido hipocloroso (HOCl), que actúa como biocida general, matando gérmenes, microorganismos, algas, etc.
Respiradores
El alcoholímetro es una reacción redox. Cuando el dicromato de potasio reacciona con etanol pierde un átomo de oxígeno (se reduce), pasando del dicromato naranja al sulfato de cromo verde. Al mismo tiempo se está reduciendo el dicromato, el etanol gana un átomo de oxígeno (se oxida), formando ácido acético. El ácido sulfúrico ayuda a eliminar el etanol del aire exhalado a la solución de prueba y además proporciona las condiciones ácidas necesarias.
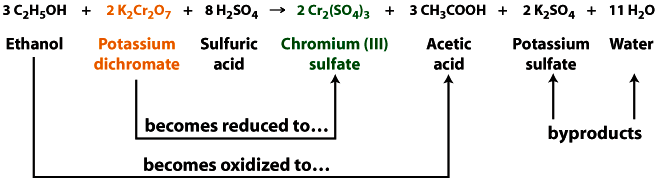
En esta reacción, el átomo de cromo se reduce de\(Cr^{6+}\) a\(Cr^{3+}\), y el etanol se oxida a ácido acético.
El peróxido de hidrógeno se puede utilizar para la esterilización de diversas superficies, incluyendo herramientas quirúrgicas y puede desplegarse como vapor (VHP) para la esterilización de la habitación. \(\ce{H2O2}\)demuestra eficacia de amplio espectro contra virus, bacterias, levaduras y esporas bacterianas. En general, se observa mayor actividad frente a bacterias Gram-positivas que Gram-negativas; sin embargo, la presencia de catalasa u otras peroxidasas en estos organismos puede incrementar la tolerancia en presencia de concentraciones más bajas. Se requieren concentraciones más altas de\(\ce{H2O2}\) (10 a 30%) y tiempos de contacto más largos para la actividad esporicida.
El peróxido de hidrógeno es visto como una alternativa ambientalmente segura a los blanqueadores a base de cloro, ya que se degrada para formar oxígeno y agua y generalmente es reconocido como seguro como agente antimicrobiano por la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA).
Históricamente, el peróxido de hidrógeno se utilizó para desinfectar heridas, en parte debido a su bajo costo y pronta disponibilidad en comparación con otros antisépticos. Ahora se piensa que inhibe la cicatrización e induce la cicatrización porque destruye las células cutáneas recién formadas. Sólo una concentración muy baja de
\(\ce{H2O2}\)puede inducir la curación, y solo si no se aplica repetidamente. El uso quirúrgico puede conducir a la formación de embolia gaseosa. A pesar de esto, todavía se usa para el tratamiento de heridas en muchos países pero también es prevalente como un importante antiséptico de primeros auxilios en Estados Unidos
Diluido\(\ce{H2O2}\) (entre 1.9% y 12%) mezclado con amoníaco acuoso se utiliza para decolorar el cabello humano. La propiedad blanqueadora del químico le da nombre a la frase “rubia de peróxido”. El peróxido de hidrógeno también se utiliza para blanquear los dientes. Se puede encontrar en la mayoría de las pastas dentales blanqueadoras.
Casi todas las aplicaciones del permanganato de potasio (\(\ce{KMnO4}\)) explotan sus propiedades oxidantes. Como oxidante fuerte que no genera subproductos tóxicos,\(\ce{KMnO4}\) tiene muchos usos de nicho. El permanganato de potasio se utiliza para una serie de afecciones de la piel. Esto incluye infecciones fúngicas del pie, impétigo, pénfigo, heridas superficiales, dermatitis y úlceras tropicales. Se encuentra en la Lista Modelo de Medicamentos Esenciales de la OMS, los medicamentos más importantes necesarios en un sistema básico de salud. El permanganato de potasio se usa ampliamente en la industria de tratamiento de agua.
El peróxido de benzoilo (BPO) es un medicamento y químico industrial. Como medicamento, se usa para tratar el acné leve a moderado. Para casos más severos, puede ser utilizado con otros tratamientos. Algunas versiones se venden mezcladas con antibióticos como la clindamicina. Otros usos incluyen la harina decolorante, el blanqueamiento del cabello, el blanqueamiento dental y el blanqueamiento textil. [5] También se utiliza en la industria del plástico
El hipoclorito de sodio se encuentra con mayor frecuencia como una solución diluida de color amarillo verdoso pálido comúnmente conocida como lejía líquida o simplemente lejía, un químico doméstico ampliamente utilizado (desde el siglo XVIII) como desinfectante o agente blanqueador. El compuesto en solución es inestable y se descompone fácilmente, liberando cloro, que es el principio activo de dichos productos. De hecho, el hipoclorito de sodio es el blanqueador a base de cloro más antiguo y aún más importante.
Si bien el hipoclorito de sodio no es tóxico, sus propiedades corrosivas, disponibilidad común y productos de reacción lo convierten en un riesgo significativo para la seguridad. En particular, mezclar lejía líquida con otros productos de limpieza, como ácidos o amoníaco, puede producir humos tóxicos.
Resumen
- El oxígeno es uno de los elementos más reactivos. Esta reactividad, aunada a su abundancia, hace que la química del oxígeno sea muy rica y bien entendida.
- Muchos compuestos de los metales y no metales representativos reaccionan con el oxígeno para formar óxidos.
- Aparte del oxígeno, ozono, cloro, dicromato de potasio, peróxido de hidrógeno, peróxido de potasio, peróxido de benzoilo, hipoclorito de sodio son los agentes oxidantes comunes mencionados en esta sección, que tienen muchos usos beneficiosos.
Colaboradores y Atribuciones
Paul Flowers (University of North Carolina - Pembroke), Klaus Theopold (University of Delaware) and Richard Langley (Stephen F. Austin State University) with contributing authors. Textbook content produced by OpenStax College is licensed under a Creative Commons Attribution License 4.0 license. Download for free at http://cnx.org/contents/85abf193-2bd...a7ac8df6@9.110).
- Wikipedia

