8.4: Corrosión y Explosión
- Page ID
- 72286
- Entender el proceso de corrosión.
- Entender el proceso de explosión.
La corrosión es un proceso galvánico por el cual los metales se deterioran a través de la oxidación, generalmente pero no siempre a sus óxidos. Por ejemplo, cuando se exponen al aire, las oxidaciones de hierro, los deslustrados de plata y el cobre y el latón adquieren una superficie de color verde azulado llamada pátina. De los diversos metales sometidos a corrosión, el hierro es, con mucho, el más importante comercialmente. Se estima que solo en Estados Unidos se gastan 100 mil millones de dólares anuales para reemplazar objetos que contienen hierro destruidos por la corrosión.
Las explosiones pueden ocurrir en la naturaleza debido a una gran afluencia de energía. La mayoría de las explosiones naturales surgen de procesos volcánicos de diversos tipos. Las explosiones químicas, suelen implicar una reacción de oxidación rápida y violenta que produce grandes cantidades de gas caliente. La pólvora fue el primer explosivo en ser descubierto y puesto en uso. Otros avances notables en la tecnología química explosiva fueron el desarrollo de nitrocelulosa por Frederick Augustus Abel en 1865 y la invención de la dinamita por Alfred Nobel en 1866. Las explosiones químicas (tanto intencionales como accidentales) a menudo son iniciadas por una chispa eléctrica o llama en presencia de oxígeno. Se pueden producir explosiones accidentales en tanques de combustible, motores de cohetes, etc.
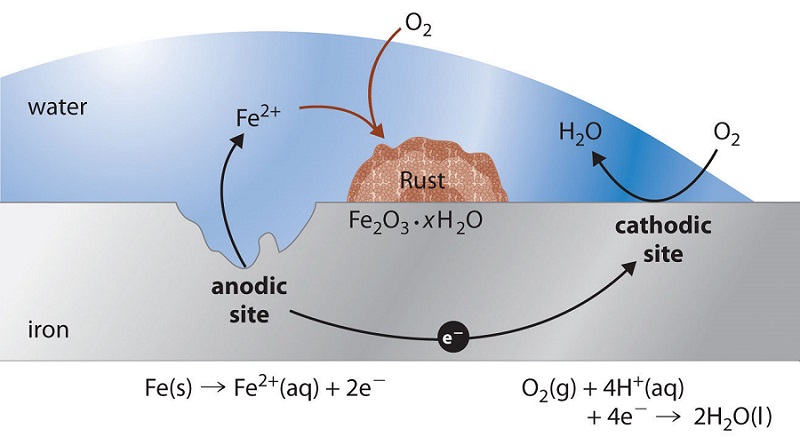
La oxidación del hierro
Quizás el ejemplo más familiar de corrosión es la formación de óxido en el hierro. El hierro se oxidará cuando se expone al oxígeno y al agua. Los principales pasos en la oxidación del hierro parecen involucrar lo siguiente. Una vez expuesto a la atmósfera, el hierro se oxida rápidamente.
\[\ce{Fe(s) -> Fe^{2+}(aq) + 2e^{-}} \tag{cathode} \]
Los electrones reducen el oxígeno en el aire en soluciones ácidas.
\[\ce{O2(g) + 4H^{+}(aq) + 4e^{-} -> 2H_2O(l)} \tag{anode} \]
\[\ce{2Fe(s) + O2(g) + 4H^{+}(aq) -> 2Fe^{2+}(aq) + 2H2O(l)} \tag{over all} \]
Lo que llamamos óxido es óxido de hierro hidratado (III), que se forma cuando los iones de hierro (II) reaccionan más con el oxígeno.
\[\ce{4Fe^{2+}(aq) + O2(g) + (4+2x)H2O(l) -> 2Fe2O3 \cdot x H2O(s) + 8H^{+}(aq)} \nonumber \]
El número de moléculas de agua es variable, por lo que está representado por x. A diferencia de la pátina sobre el cobre, la formación de óxido no crea una capa protectora y por lo tanto la corrosión del hierro continúa a medida que el óxido se desprende y expone el hierro fresco a la atmósfera.
Una forma de evitar que el hierro se corroa es mantenerlo pintado. Otras estrategias incluyen alear el hierro con otros metales. Por ejemplo, el acero inoxidable es principalmente hierro con un poco de cromo. El hierro cincado o galvanizado utiliza una estrategia diferente. El zinc se oxida más fácilmente que el hierro porque el zinc tiene un menor potencial de reducción. Dado que el zinc tiene un menor potencial de reducción, es un metal más activo. Así, aunque el recubrimiento de zinc esté rayado, el zinc aún se oxidará antes que el hierro. Esto sugiere que este enfoque debería funcionar con otros metales activos.
La Estatua de la Libertad es un hito que todos los estadounidenses reconocen. La Estatua de la Libertad se identifica fácilmente por su altura, postura y color azul verdoso único. Cuando esta estatua fue entregada por primera vez desde Francia, su aspecto no era verde. Era marrón, el color de su “piel” de cobre. Entonces, ¿cómo cambió de color la Estatua de la Libertad? El cambio de apariencia fue resultado directo de la corrosión. El cobre que es el componente principal de la estatua sufrió lentamente la oxidación del aire. Las reacciones de oxidación-reducción del cobre metálico en el ambiente ocurren en varias etapas. El metal cobre se oxida a óxido de cobre (I\(\ce{Cu_2O}\)) (), que es rojo, y luego a óxido de cobre (II), que es negro.
\[\ce{2Cu(s)} +\ce{1/2 O2(g)} \rightarrow \underset{\text{red}}{\ce{Cu2O(s)} } \nonumber \]
\[\ce{Cu2O(s)} +\ce{1/2 O2(g)}\rightarrow \underset{\text{black}}{\ce{2CuO(s)} } \nonumber \]
El carbón, que a menudo era alto en azufre, se quemaba extensamente a principios del siglo pasado. Como resultado, el trióxido de azufre, el dióxido de carbono y el agua reaccionaron con el\(\ce{CuO}\).
\[\ce{2CuO(s)} + \ce{CO2(g)} + \ce{H2O(l)} \rightarrow \underset{\text{green}}{\ce{Cu2CO3(OH)2(s)} } \nonumber \]
\[\ce{3CuO(s)} + \ce{2CO2(g)}+\ce{H2O(l)} \rightarrow \underset{\text{blue}}{\ce{Cu_2(CO_3)2(OH)2(s)} } \nonumber \]
\[\ce{4CuO(s)} + \ce{SO3(g)}+\ce{3H2O(l)} \rightarrow \underset{\text{green}}{\ce{Cu_4SO4(OH)6(s)} } \nonumber \]
Estos tres compuestos son los responsables de la característica pátina azul-verde que se ve hoy en día. Afortunadamente, la formación de la pátina creó una capa protectora en la superficie, evitando una mayor corrosión de la piel de cobre. La formación de la capa protectora es una forma de pasivación, la cual se discute en otra parte.

Deslustre de Plata
Aunque se sabe que los metales de acuñación son resistentes al oxígeno en el aire, la plata se deslustrará debido a\(\ce{H2S(g)}\)
\[\ce{2Ag(s) + H_2S(g) -> Ag2S(s) + H2(g)} \nonumber \]
Reacciones Explosivas
TNT es uno de los explosivos más utilizados para aplicaciones militares, industriales y mineras. TNT se ha utilizado en conjunto con la fracturación hidráulica, un proceso utilizado para recuperar petróleo y gas de formaciones de esquisto. La técnica consiste en desplazar y detonar nitroglicerina en fracturas inducidas hidráulicamente seguidas de disparos de pozo utilizando TNT peletizado.
El TNT se valora en parte por su insensibilidad al choque y la fricción, con menor riesgo de detonación accidental en comparación con explosivos más sensibles como la nitroglicerina. El TNT se funde a 80 °C (176 °F), muy por debajo de la temperatura a la que detonará espontáneamente, permitiendo que se vierta o se combine de manera segura con otros explosivos. TNT no absorbe ni disuelve en el agua, lo que permite su uso efectivo en ambientes húmedos. Para detonar, el TNT debe ser activado por una onda de presión procedente de un explosivo de arranque, llamado booster explosivo.
Aunque los bloques de TNT están disponibles en varios tamaños (por ejemplo, 250 g, 500 g, 1,000 g), se encuentra más comúnmente en mezclas explosivas sinérgicas que comprenden un porcentaje variable de TNT más otros ingredientes
Tras la detonación, el TNT se descompone de la siguiente manera:
\[\ce{2 C7H5N3O6 → 3 N2 + 5 H2O + 7 CO + 7 C} \nonumber \]
\[\ce{2 C7H5N3O6 → 3 N2 + 5 H2 + 12 CO + 2 C} \nonumber \]
La reacción es exotérmica pero tiene una alta energía de activación en fase gaseosa (~62 kcal/mol). Las fases condensadas (sólidas o líquidas) muestran energías de activación notablemente menores de aproximadamente 35 kcal/mol debido a las rutas únicas de descomposición bimolecular a densidades elevadas. Debido a la producción de carbono, las explosiones de TNT tienen una apariencia holgada. Debido a que el TNT tiene un exceso de carbono, las mezclas explosivas con compuestos ricos en oxígeno pueden producir más energía por kilogramo que el TNT solo. Durante el siglo XX, amatol, una mezcla de TNT con nitrato de amonio, fue un explosivo militar ampliamente utilizado.
El TNT se puede detonar con un iniciador de alta velocidad o por conmoción cerebral eficiente. Durante muchos años, el TNT solía ser el punto de referencia para la Figura de Insensibilidad. TNT tenía una calificación de exactamente 100 en la escala “F of I”. Desde entonces se ha cambiado la referencia a un explosivo más sensible llamado RDX, que tiene una calificación F de I de 80.
ANFO (o AN/FO, para nitrato de amonio/fuelóleo) es un explosivo industrial a granel ampliamente utilizado. Su nombre se pronuncia comúnmente como “an-fo”. Consiste en 94% de nitrato amónico poroso (\(\ce{NH4NO3}\)) (AN), que actúa como agente oxidante y absorbente para el combustible, y 6% fuel oil número 2 (FO). El componente combustible de ANFO es típicamente diesel, pero en su lugar se han utilizado queroseno, polvo de carbón, combustible de carreras o incluso melaza. El aluminio finamente pulverizado en la mezcla la sensibilizará para detonar más fácilmente.
La química de la detonación de ANFO es la reacción del nitrato de amonio con un alcano de cadena larga (\(\ce{C_nH_{$2n+2$}}\)) para formar nitrógeno, dióxido de carbono y agua.
\[\ce{NH4NO3 + C_nH2_{$n+2$} → xN2 + yH2O + zCO2} \nonumber \]
En una reacción ideal estequiométricamente equilibrada, ANFO se compone de aproximadamente 94.3% AN y 5.7% FO por\ (\ ce {peso. En la práctica, se agrega un ligero exceso de fuel oil, ya que la infradosificación da como resultado un rendimiento reducido, mientras que la sobredosificación simplemente resulta en más humos posteriores a la explosión. Cuando las condiciones de detonación son óptimas, los gases mencionados son los únicos productos. En el uso práctico, tales condiciones son imposibles de alcanzar, y las explosiones producen cantidades moderadas de gases tóxicos como monóxido de carbono y óxidos de nitrógeno (NOx).
\[\ce{NH4NO3 + C_nH_{$2n+2$} → vCO + wNOx + yH2O + zCO2} \nonumber \]
ANFO ha encontrado un amplio uso en la minería de carbón, canteras, minería metálica y construcción civil en aplicaciones donde su bajo costo y facilidad de uso pueden superar los beneficios de otros explosivos, como resistencia al agua, balance de oxígeno, mayor velocidad de detonación o rendimiento en columnas de pequeño diámetro. El ANFO también se usa ampliamente en la mitigación de riesgos de avalancha.
Resumen
- La corrosión y la explosión son dos procesos redox principales.
- Se dan ejemplos de corrosión (deterioro del metal) y explosión (usando TNT y ANFO).
Colaboradores y Atribuciones
Paul Flowers (University of North Carolina - Pembroke), Klaus Theopold (University of Delaware) and Richard Langley (Stephen F. Austin State University) with contributing authors. Textbook content produced by OpenStax College is licensed under a Creative Commons Attribution License 4.0 license. Download for free at http://cnx.org/contents/85abf193-2bd...a7ac8df6@9.110).
- TextMap: Chemistry-A Central Science (Brown et al.)
- Wikipedia

