9.5: Alcoholes, Fenoles y Éteres
- Page ID
- 72557
- Describir la estructura y propiedades de alcoholes, éteres y fenoles.
- Conocer el nombre y usos de alcoholes simples, fenoles y éteres.
Un alcohol es un compuesto orgánico con un grupo funcional hidroxilo (OH) en un átomo de carbono alifático. Debido a que OH es el grupo funcional de todos los alcoholes, a menudo representamos alcoholes por la fórmula general ROH, donde R es un grupo alquilo. Los alcoholes son comunes en la naturaleza. La mayoría de las personas están familiarizadas con el alcohol etílico (etanol), el ingrediente activo de las bebidas alcohólicas, pero este compuesto es solo uno de una familia de compuestos orgánicos conocidos como alcoholes. La familia también incluye sustancias tan familiares como el colesterol y los carbohidratos. El metanol (CH 3 OH) y el etanol (CH 3 CH 2 OH) son los dos primeros miembros de la serie homóloga de alcoholes.
Nomenclatura de Alcoholes
Los alcoholes con uno a cuatro átomos de carbono se denominan frecuentemente por nombres comunes, en los que el nombre del grupo alquilo va seguido de la palabra alcohol:
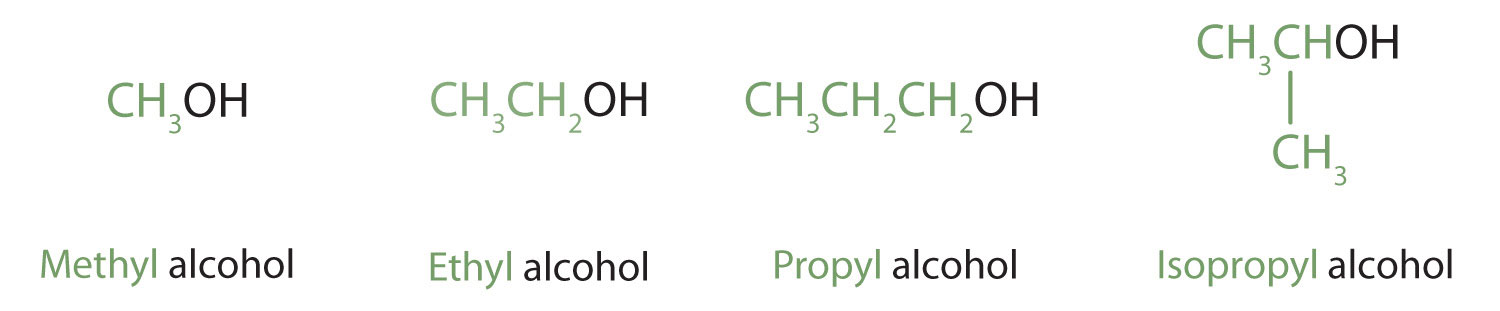
Según la Unión Internacional de Química Pura y Aplicada (IUPAC), el nombre de un alcohol proviene del hidrocarburo del que se derivó. El -e final en el nombre del hidrocarburo se reemplaza por -ol, y el átomo de carbono al que está unido el grupo —OH se indica con un número colocado antes del nombre.
Considera el siguiente ejemplo. ¿Cómo debería nombrarse?
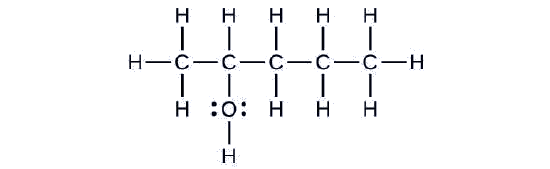
Solución
La cadena de carbono contiene cinco átomos de carbono. Si el grupo hidroxilo no estuviera presente, habríamos nombrado a esta molécula pentano. Para abordar el hecho de que el grupo hidroxilo está presente, cambiamos el final del nombre a -ol. En este caso, dado que el —OH está unido al carbono 2 en la cadena, llamaríamos a esta molécula 2-pentanol.
Nombra la siguiente molécula:
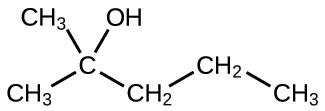
- Contestar
-
2-metil-2-pentanol
La IUPAC adoptó nuevas pautas de nomenclatura en 2013 que requieren que este número se coloque como un “infijo” en lugar de un prefijo. Por ejemplo, el nuevo nombre para 2-propanol sería propan-2-ol. La adopción generalizada de esta nueva nomenclatura llevará algún tiempo, y se alienta a los estudiantes a familiarizarse con los protocolos de nomenclatura tanto antiguos como nuevos.
Considera el siguiente ejemplo. ¿Cómo debe nombrarse de acuerdo con los lineamientos adoptados en 2013?

Solución
La cadena de carbono contiene cuatro átomos de carbono. Si el grupo hidroxilo no estuviera presente, habríamos llamado butano a esta molécula. Para abordar el hecho de que el grupo hidroxilo está presente, cambiamos el final del nombre a -ol. En este caso, dado que el —OH está unido al carbono 2 en la cadena, llamaríamos a esta molécula butan-2-ol.
“Siempre coloque el OH en el número más bajo posible para la cadena”.
En el ejemplo anterior, si los átomos de carbono se numeraran de izquierda a derecha entonces el OH se habría colocado en el tercer carbono y la molécula habría sido nombrada butan-3-ol, pero butan-2-ol es el nombre más preferido.
Nombrar las siguientes moléculas de acuerdo a los lineamientos adoptados en 2013?
a.

b.

- Contestar
-
a. propan-2-ol
b. hexan-2-ol
La tabla\(\PageIndex{1}\) nombra y clasifica algunos de los alcoholes más simples. Algunos de los nombres comunes reflejan la clasificación de un compuesto como secundario (sec -) o terciario (tert -). Estas designaciones no se utilizan en el sistema de nomenclatura IUPAC para alcoholes. Obsérvese que hay cuatro alcoholes butílicos en la tabla, correspondientes a los cuatro grupos butilo: el grupo butilo (CH 3 CH 2 CH 2 CH 2) discutido anteriormente, y otros tres:
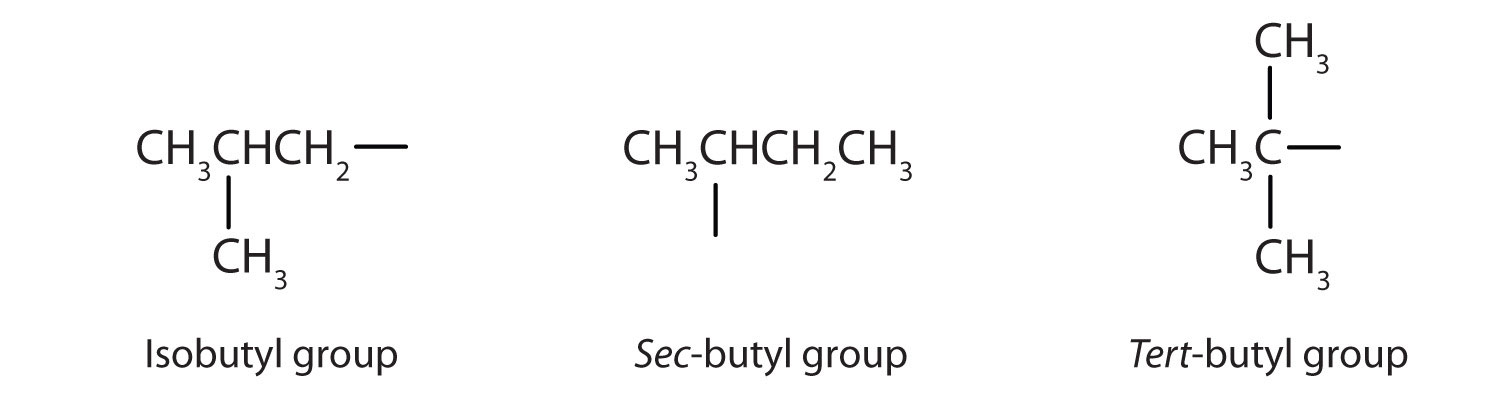
| Fórmula estructural condensada | Nombre común | Nombre IUPAC |
|---|---|---|
| CH 3 OH | alcohol de madera (alcohol metílico) | metanol |
| CH 3 CH 2 OH | alcohol de grano (alcohol etílico) | etanol |
| CH 3 CH 2 CH 2 OH | alcohol propilo | 1-propanol |
| (CH 3) 2 CHOH | alcohol para frotar (alcohol isopropílico) | 2-propanol |
| CH 3 CH 2 CH 2 CH 2 OH | alcohol butílico | 1-butanol |
| CH 3 CH 2 CHOHCH 3 | alcohol sec -butílico | 2-butanol |
| (CH 3) 2 CHCH 2 OH | alcohol isobutílico | 2-metil-1-propanol |
| (CH 3) 3 COH | alcohol terc - butílico | 2-metil-2-propanol |
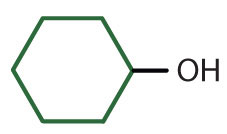 |
alcohol ciclohexílico | ciclohexanol |
Metanol (alcohol metílico)
El metanol, también conocido como alcohol metílico entre otros, es un químico con la fórmula CH 3 OH (un grupo metilo unido a un grupo hidroxilo, a menudo abreviado MeOH). El metanol adquirió el nombre de alcohol de madera porque alguna vez fue producido principalmente por la destilación destructiva de la madera. Hoy en día, el metanol se produce principalmente industrialmente por hidrogenación de monóxido de carbono.
CO (g) + 2H 2 (g) → CH 3 OH (l)
El metanol es el alcohol más simple, que consiste en un grupo metilo unido a un grupo hidroxilo. Es un líquido ligero, volátil, incoloro e inflamable con un olor distintivo similar al del etanol (alcohol para beber). A temperatura ambiente, es un líquido polar. Con más de 20 millones de toneladas producidas anualmente, se utiliza como aditivo de combustible y como precursor de otros productos químicos básicos, incluyendo formaldehído, ácido acético, metil terc-butil éter, así como una gran cantidad de productos químicos más especializados.
Etanol (alcohol etílico)
El etanol (también llamado alcohol etílico, alcohol de grano, alcohol para beber, o simplemente alcohol) es un compuesto químico, un alcohol simple con la fórmula química C 2 H 6 O. Su fórmula también se puede escribir como CH 3 − CH 2-OH o C 2H 5 OH (un grupo etilo unido a un grupo hidroxilo), y a menudo se abrevia como EtOH. El etanol es un líquido volátil, inflamable e incoloro con un ligero olor característico. Es una sustancia psicoactiva y es el principal tipo de alcohol que se encuentra en las bebidas alcohólicas.
El etanol es producido naturalmente por la fermentación de azúcares por levaduras o mediante procesos petroquímicos, y se consume más comúnmente como una droga recreativa popular. El etanol es el alcohol producido por algunas especies de levadura que se encuentra en el vino, la cerveza y las bebidas destiladas. Durante mucho tiempo ha sido preparado por humanos aprovechando los esfuerzos metabólicos de las levaduras en la fermentación de diversos azúcares:
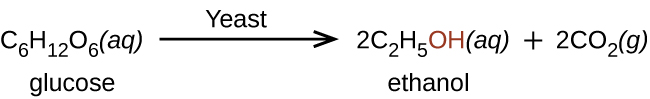
Se sintetizan grandes cantidades de etanol (para uso industrial) a partir de la reacción de adición de agua con etileno usando un ácido como catalizador:
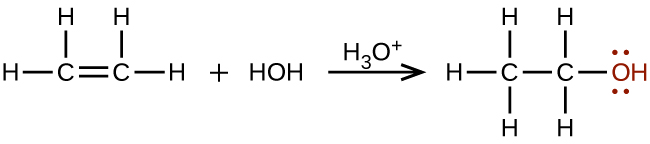
El etanol también tiene aplicaciones médicas como antiséptico y desinfectante. El compuesto es ampliamente utilizado como solvente químico, ya sea para pruebas químicas científicas o en la síntesis de otros compuestos orgánicos, y es una sustancia vital utilizada en muchos tipos diferentes de industrias manufactureras. El etanol también se utiliza como fuente de combustible de combustión limpia.
Toxicidad de Alcoholes
Con respecto a la toxicidad aguda, los alcoholes simples tienen bajas toxicidades agudas. Se toleran dosis de varios mililitros. Para pentanoles, hexanoles, octanoles y alcoholes más largos, la DL50 (dosis letal, 50%) oscila entre 2—5 g/kg (ratas, oral). El metanol y el etanol son menos tóxicos. Sin embargo, el metanol es mucho más tóxico que el etanol. Todos los alcoholes son irritantes suaves de la piel.
El metabolismo del metanol (y etilenglicol) se ve afectado por la presencia de etanol, el cual tiene una mayor afinidad por la alcohol deshidrogenasa hepática. De esta manera el metanol se excretará intacto en la orina.
El efecto inmediato del alcohol depende de la concentración de alcohol en sangre (BAC) del bebedor. El BAC puede ser diferente para cada persona dependiendo de su edad, sexo, condición de salud preexistente, incluso si beben la misma cantidad de alcohol.
Diferentes BAC tienen diferentes efectos. En la tabla se\(\PageIndex{2}\) enumeran los efectos comunes del alcohol en el organismo dependiendo del BAC. Sin embargo, la tolerancia varía considerablemente entre individuos, al igual que la respuesta individual a una dosis determinada; los efectos del alcohol difieren ampliamente entre las personas. De ahí que en este contexto, los porcentajes de BAC sean solo estimaciones utilizadas con fines ilustrativos.
| mg/dL | MM |
Nivel de Alcohol en Sangre % v/v |
Efectos |
|---|---|---|---|
| 50 | 11 | 0.05% | Euforia, locución, relajación |
| 100 | 22 | 0.1% | Depresión del sistema nervioso central, náuseas, posibles vómitos, alteración de la función motora y sensorial, deterioro de la cognición |
| >140 | 30 | > 0.14% | Disminución del flujo sanguíneo al cerebro |
| 300 | 65 | 0.3% | Estupefacción, posible inconsciencia |
| 400 | 87 | 0.4% | Posible muerte |
| 500 | 109 | > 0.55% | Muerte |
- Alcohol para frotar se refiere a alcohol isopropílico (propan-2-ol) o líquidos a base de etanol. El alcohol para frotar es inbebible aunque sea a base de etanol, debido a los amargantes añadidos. Las etiquetas de los productos para frotar alcohol incluyen una serie de advertencias sobre el producto químico, incluidos los peligros de inflamabilidad y su uso previsto solo como antiséptico tópico y no para heridas internas o consumo. Debe usarse en un área bien ventilada debido a peligros de inhalación. El envenenamiento puede ocurrir por ingestión, inhalación, absorción o consumo de alcohol.
Alcoholes Multifuncionales
Un poliol es un compuesto orgánico que contiene múltiples grupos hidroxilo. Los ejemplos de polioles discutidos en esta sección incluyen etilenglicol, propilenglicol y glicerol.
Se pueden elaborar alcoholes que contienen dos o más grupos hidroxilo. Los ejemplos incluyen 1,2-etanodiol (etilenglicol, usado en anticongelante) y 1,2,3-propanotriol (glicerina, utilizado como disolvente para cosméticos y medicamentos):
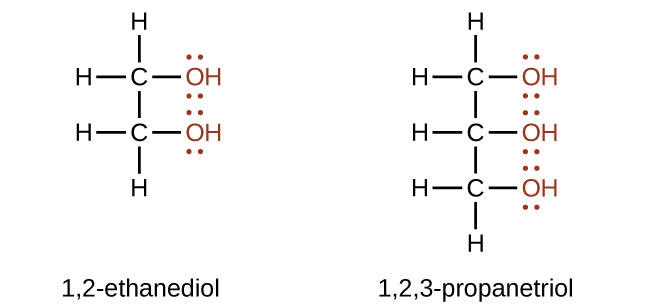
El etilenglicol (nombre de la IUPAC: etano-1,2-diol) es un compuesto orgánico con la fórmula (CH 2 OH) 2. Se utiliza principalmente para dos propósitos, como materia prima en la fabricación de fibras de poliéster y para formulaciones anticongelantes. Es un líquido viscoso inodoro, incoloro, de sabor dulce. El etilenglicol es tóxico. Las mascotas domésticas son especialmente susceptibles a la intoxicación por etilenglicol por fugas anticongelantes de vehículos.


El propilenglicol (nombre de la IUPAC: propano-1,2-diol) es un compuesto orgánico con la fórmula química CH 3 CH (OH) CH 2 OH. Es un líquido viscoso e incoloro que es casi inodoro pero posee un sabor débilmente dulce. Con dos grupos alcohol, se clasifica como diol. Es misciblecon una amplia gama de solventes, incluyendo agua, acetona y cloroformo. En general, los glicoles no son irritantes, tienen muy baja volatilidad y muy baja toxicidad.


Cuarenta y cinco por ciento del propilenglicol producido se utiliza como materia prima química para la producción de resinas de poliéster insaturado. El propilenglicol también se usa en diversos artículos comestibles como bebidas a base de café, edulcorantes líquidos, helados, productos lácteos batidos y refrescos. Los vaporizadores utilizados para la entrega de productos farmacéuticos o productos de cuidado personal a menudo incluyen propilenglicol entre los ingredientes. En los desinfectantes de manos a base de alcohol, se utiliza como humectante para evitar que la piel se seque. El propilenglicol se usa como disolvente en muchos productos farmacéuticos, incluyendo formulaciones orales, inyectables y tópicas, como para diazepam y lorazepam que son insolubles en agua. Ciertas formulaciones de lágrimas artificiales, como Systane, usan proplyene glicol como ingrediente.El propilenglicol se usa frecuentemente como sustituto del etilenglicol en anticongelante automotriz de baja toxicidad y amigable con el medio ambiente. También se utiliza para acondicionar los sistemas de plomería para el invierno en estructuras vacantes.
El glicerol (/ˈlɪsərl/; también llamado glicerina o glicerina; ver diferencias ortográficas) es un compuesto de poliol simple. Es un líquido incoloro, inodoro, viscoso, de sabor dulce y no tóxico. La cadena principal de glicerol se encuentra en muchos lípidos que se conocen como glicéridos. Es ampliamente utilizado en la industria alimentaria como edulcorante y humectante en formulaciones farmacéuticas. El glicerol tiene tres grupos hidroxilo que son responsables de su solubilidad en agua y su naturaleza higroscópica.

En alimentos y bebidas, el glicerol sirve como humectante, solvente y edulcorante, y puede ayudar a conservar los alimentos. También se utiliza como relleno en alimentos bajos en grasa preparados comercialmente (por ejemplo, galletas), y como agente espesante en licores. El glicerol y el agua se utilizan para preservar ciertos tipos de hojas de plantas. Como sustituto del azúcar, tiene aproximadamente 27 kilocalorías por cucharadita (el azúcar tiene 20) y es 60% tan dulce como la sacarosa. No alimenta a las bacterias que forman placas y causan caries dentales. [cita necesaria] Como aditivo alimentario, el glicerol se etiqueta con el número E E422. Se agrega al glaseado (glaseado) para evitar que se endurezca demasiado.
El glicerol se usa en preparaciones médicas, farmacéuticas y de cuidado personal, a menudo como un medio para mejorar la suavidad, proporcionar lubricación y como humectante. La ictiosis y la xerosis han sido aliviadas por el uso tópico de glicerina. Se encuentra en inmunoterapias alergénicas, jarabes para la tos, elixires y expectorantes, pasta de dientes, enjuagues bucales, productos para el cuidado de la piel, crema de afeitar, productos para el cuidado del cabello, jabones y lubricantes personales a base de agua (Figura\(\PageIndex{10}\)). En formas de dosificación sólidas como tabletas, el glicerol se usa como agente de retención de tabletas.
Fenoles
Los compuestos en los que un grupo OH está unido directamente a un anillo aromático se denominan AroH y se denominan fenoles. Los fenoles difieren de los alcoholes en que son ligeramente ácidos en el agua. Reaccionan con hidróxido de sodio acuoso (NaOH) para formar sales.
\[\ce{ArOH (aq) + NaOH (aq) \rightarrow ArONa (aq) + H_2O} \nonumber \]
El compuesto parental, C 6 H 5 OH, en sí mismo se llama fenol. (Un nombre antiguo, enfatizando su ligera acidez, era ácido carbólico.) El fenol es un compuesto cristalino blanco que tiene un olor distintivo (“olor hospitalario”).

A Su Salud: Fenoles y Nosotros
Los fenoles son ampliamente utilizados como antisépticos (sustancias que matan microorganismos en tejidos vivos) y como desinfectantes (sustancias destinadas a matar microorganismos en objetos inanimados como muebles o pisos). El primer antiséptico ampliamente utilizado fue el fenol. Joseph Lister lo utilizó para cirugía antiséptica en 1867. Sin embargo, el fenol es tóxico para los humanos y puede causar quemaduras graves cuando se aplica a la piel. En el torrente sanguíneo, es un veneno sistémico, es decir, uno que se transporta y afecta a todas las partes del cuerpo. Sus severos efectos secundarios llevaron a la búsqueda de antisépticos más seguros, algunos de los cuales se han encontrado.
Un antiséptico fenólico más seguro es 4-hexilresorcinol (4-hexil-1,3-dihidroxibenceno; resorcinol es el nombre común para 1,3-dihidroxibenceno y 4-hexilresorcinol tiene un grupo hexilo en el cuarto átomo de carbono del anillo de resorcinol). Es mucho más potente que el fenol como germicida y tiene menos efectos secundarios indeseables. En efecto, es lo suficientemente seguro como para ser utilizado como ingrediente activo en algunos enjuagues bucales y pastillas para la garganta.
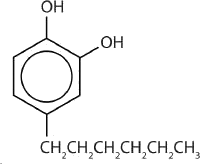
Además de actuar como antiséptico, el fenol también es un precursor útil en muchas síntesis químicas para producir productos farmacéuticos, conservantes de alimentos, polímeros, resinas y adhesivos. Los fenólicos también están presentes en una serie de sistemas biológicos y productos naturales como neurotransmisores, agentes aromatizantes y vitaminas, por nombrar algunos.
Abajo: eugenal; ácido 2,4-diclorofenoxiacético; propofol
Éteres
Los éteres son compuestos que contienen el grupo funcional —O—. Los éteres no tienen un sufijo designado como los otros tipos de moléculas que hemos nombrado hasta ahora. En el sistema IUPAC, el átomo de oxígeno y la rama de carbono más pequeña se nombran como sustituyente alcoxi y el resto de la molécula como la cadena base, como en alcanos. Como se muestra en el siguiente compuesto, los símbolos rojos representan el grupo alquilo más pequeño y el átomo de oxígeno, que se denominaría “metoxi”. La rama de carbono más grande sería etano, haciendo la molécula metoxietano. Muchos éteres, como se muestra a continuación, se denominan con nombres comunes en lugar de los nombres del sistema IUPAC. Para los nombres comunes, las dos ramas conectadas al átomo de oxígeno se nombran por separado y seguidas de “éter”.
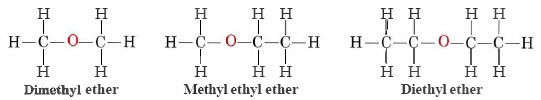
En la fórmula general para los éteres, R— O-R, los grupos hidrocarbonados (R) pueden ser iguales o diferentes.
Las moléculas de éter no tienen átomo de hidrógeno en el átomo de oxígeno (es decir, ningún grupo OH). Por lo tanto, no hay enlaces de hidrógeno intermoleculares entre las moléculas de éter y, por lo tanto, los éteres tienen puntos de ebullición bastante bajos para una masa molar dada. En efecto, los éteres tienen puntos de ebullición aproximadamente los mismos que los de los alcanos de masa molar comparable y mucho menores que los de los alcoholes correspondientes (Tabla\(\PageIndex{3}\)).
| Fórmula estructural condensada | Nombre | Masa molar | Punto de ebullición (°C) | ¿Enlace de Hidrógeno Intermolecular en Líquido Puro? |
|---|---|---|---|---|
| CH 3 CH 2 CH 3 | propano | 44 | —42 | no |
| CH 3 OCH 3 | éter dimetílico | 46 | —25 | no |
| CH 3 CH 2 OH | alcohol etílico | 46 | 78 | si |
| CH 3 CH 2 CH 2 CH 2 CH 3 | pentano | 72 | 36 | no |
| CH 3 CH 2 OCH 2 CH 3 | éter dietílico | 74 | 35 | no |
| CH 3 CH 2 CH 2 CH 2 OH | alcohol butílico | 74 | 117 | si |
Sin embargo, las moléculas de éter tienen un átomo de oxígeno y participan en enlaces de hidrógeno con moléculas de agua. En consecuencia, un éter tiene aproximadamente la misma solubilidad en agua que el alcohol que es isomérico con él. Por ejemplo, el éter dimetílico y el etanol (ambos con la fórmula molecular C 2 H 6 O) son completamente solubles en agua, mientras que el éter dietílico y el 1-butanol (ambos C 4 H 10 O) son apenas solubles en agua (8 g/100 mL de agua).
El éter dietílico, el compuesto más utilizado de esta clase, es un líquido incoloro y volátil que es altamente inflamable. Se utilizó por primera vez en 1846 como anestésico, pero mejores anestésicos ahora han ocupado en gran medida su lugar. El éter dietílico y otros éteres se utilizan actualmente principalmente como disolventes para gomas, grasas, ceras y resinas. El éter terciario -butil metílico, C 4 H 9 OCH 3 (abreviado MTBE, las porciones de nombres en cursiva no se cuentan al clasificar alfabéticamente los grupos, por lo que el butilo viene antes que el metilo en el nombre común), se usa como aditivo para la gasolina. MTBE pertenece a un grupo de químicos conocidos como oxigenados debido a su capacidad para aumentar el contenido de oxígeno de la gasolina.
Un anestésico general actúa sobre el cerebro para producir inconsciencia y una insensibilidad general a la sensación o al dolor. El éter dietílico (CH 3 CH 2 OCH 2 CH 3) fue el primer anestésico general que se utilizó.
El éter dietílico es relativamente seguro porque existe una brecha bastante amplia entre la dosis que produce un nivel efectivo de anestesia y la dosis letal. Sin embargo, debido a que es altamente inflamable y tiene la desventaja añadida de causar náuseas, ha sido reemplazada por anestésicos inhalantes más nuevos, incluyendo los compuestos que contienen flúor halotano, enflurano e isoflurano. Desafortunadamente, se ha cuestionado la seguridad de estos compuestos para el personal de quirófano. Por ejemplo, las trabajadoras de quirófano expuestas al halotano sufren una mayor tasa de abortos espontáneos que las mujeres de la población general.
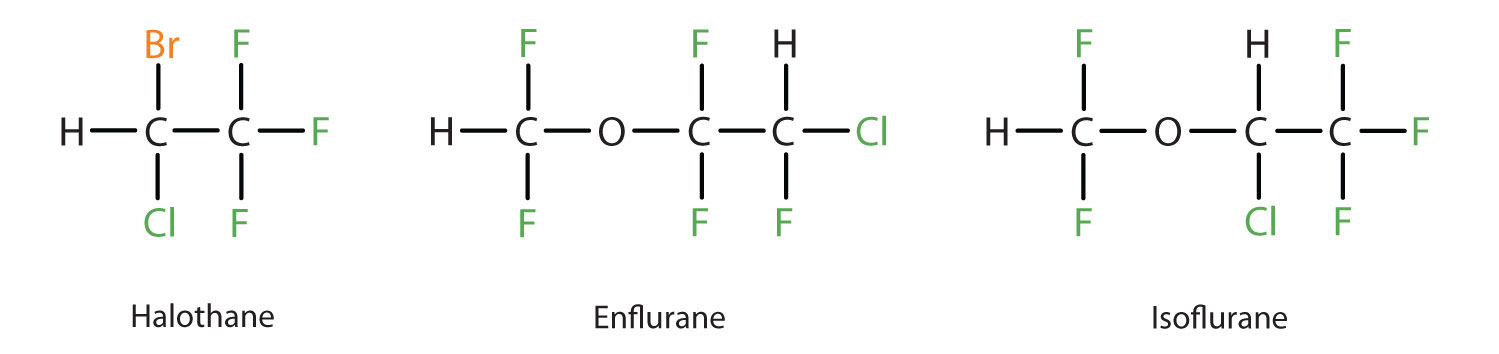
Una lista de éteres importantes y sus usos se dan en la Tabla\(\PageIndex{4}\)
 |
Óxido de etileno | También el epóxido más simple. La mayor parte del óxido de etileno se utiliza para la síntesis de etilenglicol (anticongelante), incluyendo dietilenglicol y trietilenglicol, que representa hasta 75% del consumo global. |
|---|---|---|
| Éter dimetílico | Un propulsor en aerosol. Un potencial de combustible alternativo renovable para motores diesel con una clasificación de cetano tan alta como 56—57. | |
| Éter dietílico | Un solvente común de bajo punto de ebullición (b.p. 34.6 °C) y un anestésico temprano. Se utiliza como fluido de arranque para motores diesel. También se utiliza como refrigerante y en la fabricación de pólvora sin humo, junto con su uso en perfumería. | |
 |
Dimetoxietano (DME) | Un disolvente miscible en agua que se encuentra a menudo en baterías de litio (p.e. 85 °C): |
| Didioxano | Un éter cíclico y disolvente de alto punto de ebullición (p.e. 101.1 °C). |
Identificar los siguientes compuestos como alcohol, fenol o éter.
a.
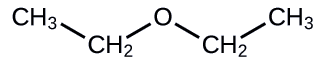

Solución
a. El compuesto tiene la fórmula general R— O —R, por lo que es un éter. b. El compuesto tiene dos grupos hidroxilo (—OH), por lo que es un alcofol.
Identificar los siguientes compuestos como alcohol, fenol o éter.
a.

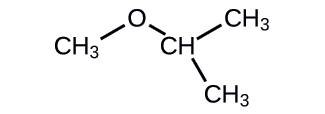
- Contestar
-
a. alcohol b. éter
Resumen
- El grupo —OH es el grupo funcional de un alcohol. Diversos alcoholes tienen una amplia gama de aplicaciones en el campo médico así como en las industrias de transporte, alimentación, cosmética.
- El nombre de un alcohol proviene del hidrocarburo del que se derivó.
- El grupo —R-O-R— es el grupo funcional de un éter. El éter dietílico y otros éteres se utilizan actualmente principalmente como disolventes para gomas, grasas, ceras y resinas. El óxido de etileno en particular se utiliza en la fabricación de etilenglicol (anticongelante).
- Los fenoles son compuestos en los que un grupo OH está unido directamente a un anillo aromático. Muchos fenoles se utilizan como antisépticos.
Colaboradores y Atribuciones
Paul Flowers (University of North Carolina - Pembroke), Klaus Theopold (University of Delaware) and Richard Langley (Stephen F. Austin State University) with contributing authors. Textbook content produced by OpenStax College is licensed under a Creative Commons Attribution License 4.0 license. Download for free at http://cnx.org/contents/85abf193-2bd...a7ac8df6@9.110).
- TextMap: The Basics of GOB Chemistry (Ball et al.)
- Wikipedia

