9.8: Compuestos que contienen nitrógeno- Aminas y Amidas
- Page ID
- 72530
- Describir la estructura y propiedades de aminas y amidas.
- Nombra aminas y amidas simples.
La adición de nitrógeno a una estructura orgánica conduce a dos familias de moléculas. Los compuestos que contienen un átomo de nitrógeno unido en una estructura hidrocarbonada se clasifican como aminas. Los compuestos que tienen un átomo de nitrógeno unido a un lado de un grupo carbonilo se clasifican como amidas.
Aminas
Una amina es un compuesto orgánico que puede considerarse derivado del amoníaco\(\left( \ce{NH_3} \right)\). Las aminas son moléculas que contienen enlaces carbono-nitrógeno. Las aminas se nombran nombrando los grupos alquilo unidos al átomo de nitrógeno, seguido del sufijo - amina como se ilustra aquí para algunos ejemplos simples:
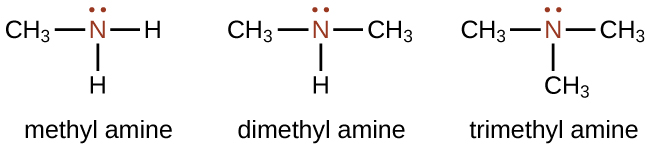
El nombre de las moléculas más grandes implica el sufijo de identificación de clase —ine, como verá más adelante en esta sección (por ejemplo, cafeína y nicotina).
La metilamina y la etilamina son gases a temperatura ambiente, mientras que las aminas más grandes son líquidos. Al igual que con otros compuestos orgánicos que forman enlaces de hidrógeno, la solubilidad en agua se refleja en la longitud de las cadenas de carbono. Las aminas más pequeñas son solubles, mientras que las más grandes son menos solubles.
Las aminas generalmente tienen olores bastante picantes o tóxicos. El amoníaco puede considerarse la amina más simple y tiene un olor muy distintivo. La metilamina tiene un olor desagradable asociado con peces muertos. Las aminas a menudo se forman biológicamente durante la descomposición de las proteínas en las células animales, y muchas tienen el olor a muerte y descomposición. La putrescina y la cadaverina son dos de esas aminas y se llaman acertadamente por sus malos olores. Las toxinas que muchos animales utilizan como forma de defensa son frecuentemente aminas. Las aminas se utilizan industrialmente como colorantes y en muchos fármacos.
Las aminas tienen olores “interesantes”. Los simples huelen mucho a amoníaco. Las aminas alifáticas superiores huelen a pescado en descomposición. O tal vez deberíamos ponerlo al revés: Los peces en descomposición desprenden aminas olorosas. El hedor del pescado podrido se debe en parte a dos diaminas: putrescina y cadaverina. Surgen de la descarboxilación de ornitina y lisina, respectivamente, aminoácidos que se encuentran en las células animales.


Las aminas aromáticas generalmente son bastante tóxicas. Se absorben fácilmente a través de la piel, y los trabajadores deben tener precaución al manipular estos compuestos. Varias aminas aromáticas, incluida la β-naftilamina, son potentes carcinógenos.
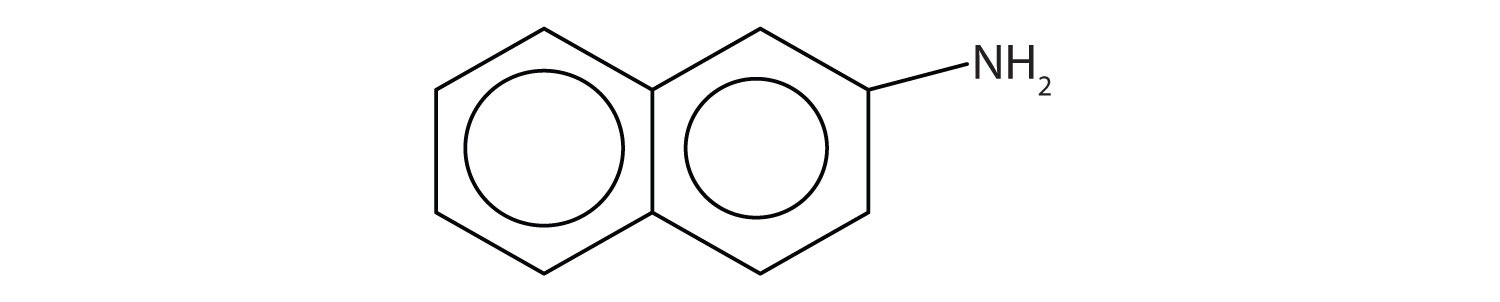
Amidas
El grupo funcional amida tiene un átomo de nitrógeno unido a un átomo de carbono carbonilo. Si los dos enlaces restantes en el átomo de nitrógeno están unidos a átomos de hidrógeno, el compuesto es una amida simple. Si uno o ambos de los dos enlaces restantes en el átomo están unidos a grupos alquilo o arilo, el compuesto es una amida sustituida.
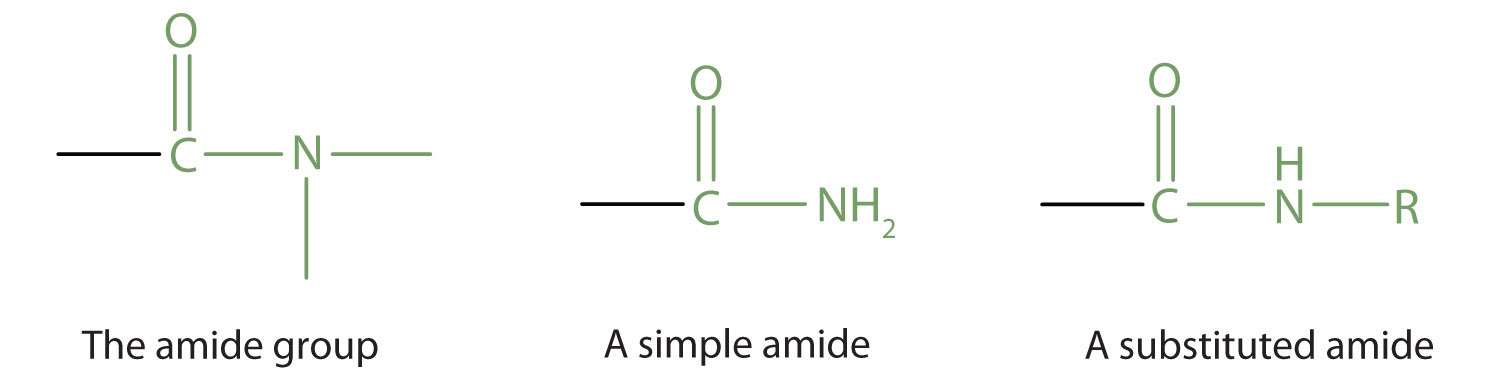
Las amidas simples se nombran como derivados de ácidos carboxílicos. La terminación - ic del nombre común o la terminación - oic de la Unión Internacional de Química Pura y Aplicada (IUPAC) nombre del ácido carboxílico se sustituye por el sufijo - amida.

Las amidas se pueden producir cuando los ácidos carboxílicos reaccionan con aminas o amoníaco en un proceso llamado amidación. Se elimina una molécula de agua de la reacción, y la amida se forma a partir de los trozos restantes del ácido carboxílico y la amina (nótese la similitud con la formación de un éster a partir de un ácido carboxílico y un alcohol discutidos en la sección anterior):
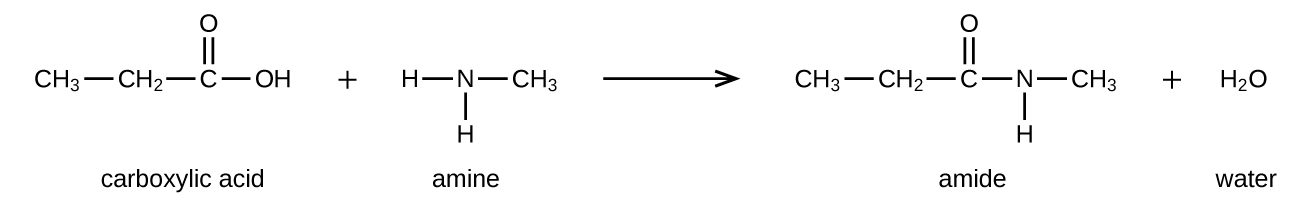
La reacción entre aminas y ácidos carboxílicos para formar amidas es biológicamente importante. Es a través de esta reacción que los aminoácidos (moléculas que contienen sustituyentes amina y ácido carboxílico) se unen en un polímero para formar proteínas.
El enlace carbono-nitrógeno carbonilo se denomina enlace amida. Este enlace es bastante estable y se encuentra en las unidades repetitivas de moléculas proteicas, donde se denomina enlace peptídico.
Las amidas son generalizadas en la naturaleza y la tecnología como materiales estructurales. El enlace amida se forma fácilmente, confiere rigidez estructural y resiste la hidrólisis. Los nylons son poliamidas, al igual que los materiales muy resistentes Aramid, Twaron y Kevlar. Los enlaces amida constituyen una característica molecular definitoria de las proteínas, cuya estructura secundaria se debe en parte a las capacidades de enlace de hidrógeno de las amidas. Los enlaces amida en un contexto bioquímico se denominan enlaces peptídicos cuando ocurren en la cadena principal de una proteína y enlaces isopeptídicos cuando ocurren a una cadena lateral de la proteína. Las proteínas pueden tener papeles estructurales, como en el cabello o la seda de araña, pero también casi todas las enzimas son proteínas. Las amidas de bajo peso molecular, como la dimetilformamida (HC (O) N (CH 3) 2), son solventes comunes. Muchos medicamentos son amidas, entre ellos el paracetamol, la penicilina y el LSD. Además, las N - alquilamidas de plantas tienen una amplia gama de funcionalidades biológicas.
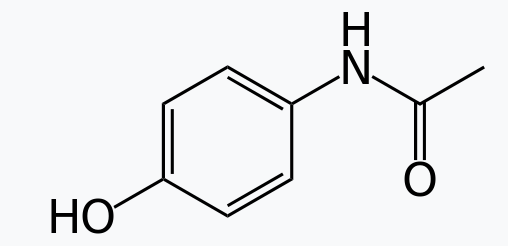


(Figura\(\PageIndex{3}\)) Paracetamol (acetaminofén) LSD (Dietilamida lisérgica)
Compuestos heterocíclicos: alcaloides y otros
Mirando hacia atrás a los diversos hidrocarburos cíclicos discutidos anteriormente, vemos que todos los átomos en los anillos de estos compuestos son átomos de carbono. En otros compuestos cíclicos, llamados compuestos heterocíclicos (heteros griegos, que significa “otro”), nitrógeno, oxígeno, azufre, o algún otro átomo se incorpora en el anillo. Muchos compuestos heterocíclicos son importantes en medicina y bioquímica. Algunos componen parte de la estructura de los ácidos nucleicos, que a su vez componen el material genético de las células y dirigen la síntesis proteica.
Muchas aminas heterocíclicas se encuentran naturalmente en las plantas. Al igual que otras aminas, estos compuestos son básicos. Tal compuesto es un alcaloide, un nombre que significa “como álcalis”. Muchos alcaloides son fisiológicamente activos, incluidos los conocidos medicamentos cafeína, nicotina y cocaína.
La cafeína es un estimulante que se encuentra en el café, el té y algunos refrescos. Su mecanismo de acción no se entiende bien, pero se piensa que bloquea la actividad de la adenosina,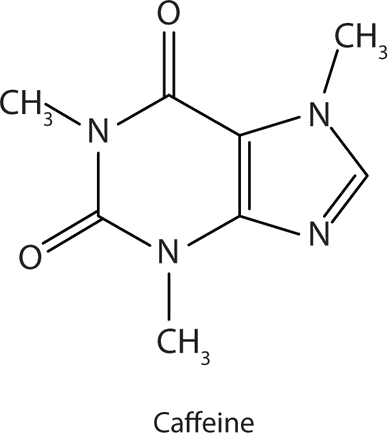 una base heterocíclica que actúa como neurotransmisor, una sustancia que transporta mensajes a través de una pequeña brecha (sinapsis) de una célula nerviosa (neurona) a otra célula. La dosis efectiva de cafeína es de aproximadamente 200 mg, lo que corresponde a aproximadamente dos tazas de café o té fuerte.
una base heterocíclica que actúa como neurotransmisor, una sustancia que transporta mensajes a través de una pequeña brecha (sinapsis) de una célula nerviosa (neurona) a otra célula. La dosis efectiva de cafeína es de aproximadamente 200 mg, lo que corresponde a aproximadamente dos tazas de café o té fuerte.
La nicotina actúa como estimulante por un mecanismo diferente; probablemente imita la acción del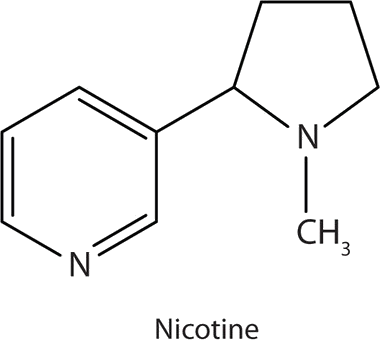 neurotransmisor acetilcolina. Las personas ingieren este medicamento fumando o masticando tabaco. Su efecto estimulante parece transitorio, ya que a esta respuesta inicial le sigue la depresión. La nicotina es altamente tóxica para los animales. Es especialmente mortal cuando se inyecta; la dosis letal para un humano se estima en unos 50 mg. La nicotina también se ha utilizado en la agricultura como insecticida de contacto.
neurotransmisor acetilcolina. Las personas ingieren este medicamento fumando o masticando tabaco. Su efecto estimulante parece transitorio, ya que a esta respuesta inicial le sigue la depresión. La nicotina es altamente tóxica para los animales. Es especialmente mortal cuando se inyecta; la dosis letal para un humano se estima en unos 50 mg. La nicotina también se ha utilizado en la agricultura como insecticida de contacto.
La cocaína actúa como estimulante al evitar que las células nerviosas absorvan dopamina, otro neurotransmisor, de la sinapsis. Por lo tanto, se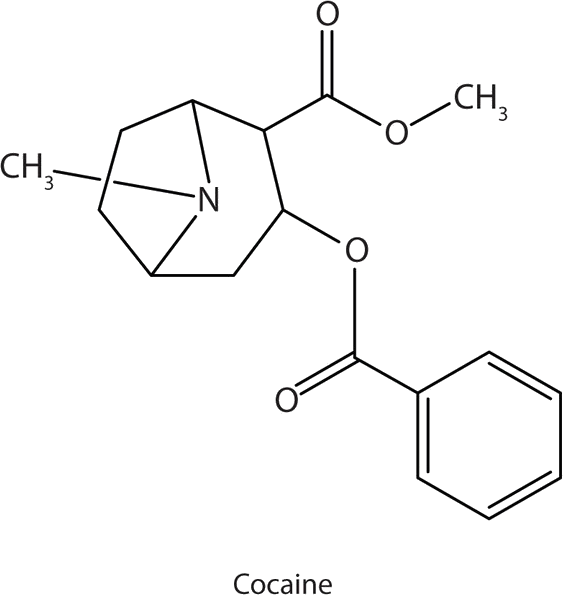 dispone de altos niveles de dopamina para estimular los centros de placer del cerebro. Se cree que la potenciación de la acción de la dopamina es responsable del “alto” de la cocaína y sus propiedades adictivas. Después del atracón, la dopamina se agota en menos de una hora. Esto deja al usuario en un estado sin placer y (a menudo) ansiando más cocaína.
dispone de altos niveles de dopamina para estimular los centros de placer del cerebro. Se cree que la potenciación de la acción de la dopamina es responsable del “alto” de la cocaína y sus propiedades adictivas. Después del atracón, la dopamina se agota en menos de una hora. Esto deja al usuario en un estado sin placer y (a menudo) ansiando más cocaína.
La cocaína se utiliza como la sal clorhidrato de cocaína y en forma de grumos rotos de la base libre (no neutralizada), que se llama cocaína crack.
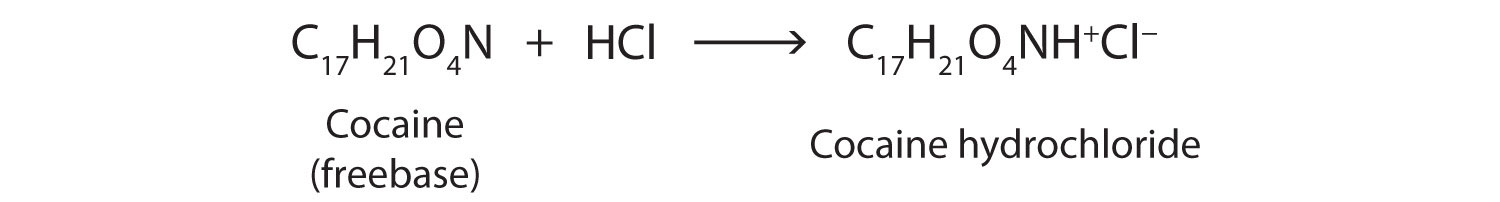
Debido a que es soluble en agua, el clorhidrato de cocaína se absorbe fácilmente a través de las membranas mucosas acuosas de la nariz cuando se resopló. La cocaína crack es más volátil que el clorhidrato de cocaína. Se vaporiza a la temperatura de un cigarrillo en llamas. Cuando se fuma, la cocaína llega al cerebro en 15 s.
La morfina, un narcótico fuerte utilizado para aliviar el dolor, contiene dos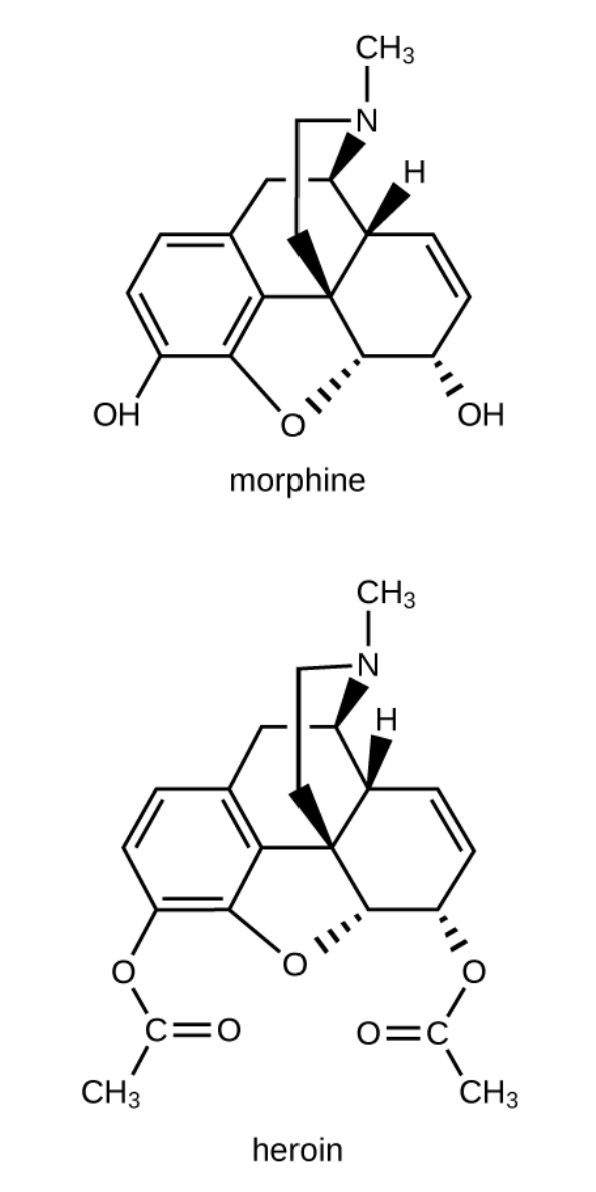 grupos funcionales hidroxilo, ubicados en la parte inferior del
grupos funcionales hidroxilo, ubicados en la parte inferior del

Identificar si cada compuesto es una amida o una amina.
a.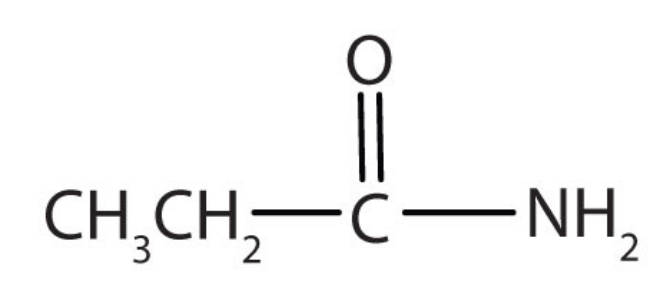
b.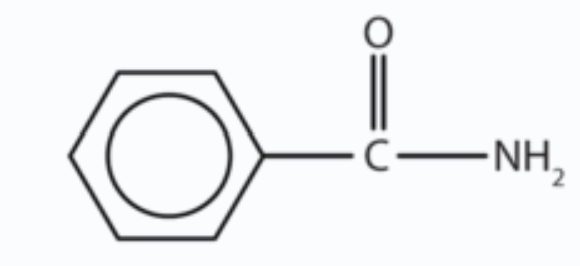
c.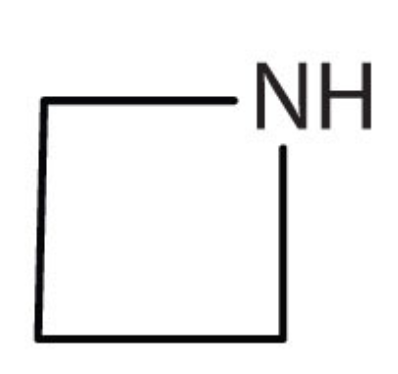
Soluciones
a. El compuesto tiene el grupo funcional CONH 2 por lo que es una amida.
b. El compuesto tiene el grupo funcional CONH 2 por lo que es una amida.
c. El compuesto tiene el grupo funcional NH por lo que es una amina.
a.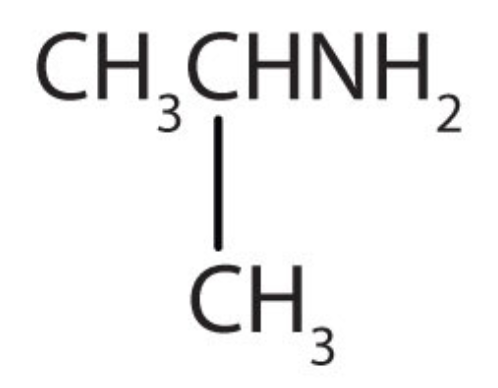
b. CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 NH 2
c.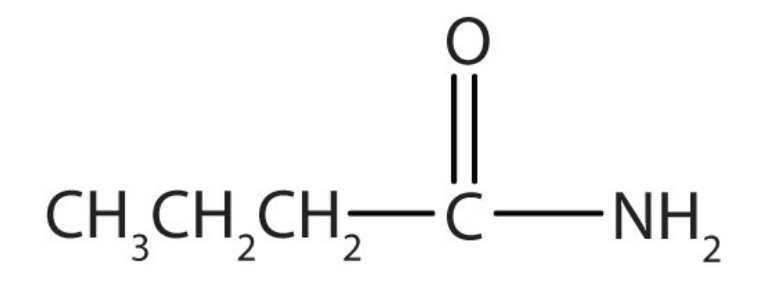
- Contestar
-
a. amina b. amina c. amida
Resumen
- Una amina es un derivado del amoníaco en el que uno, dos o los tres átomos de hidrógeno son reemplazados por grupos hidrocarbonados. El grupo funcional amina es el siguiente:
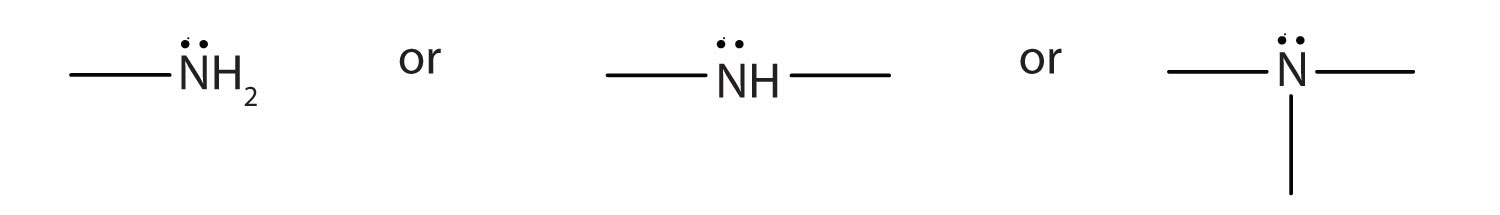
- Las aminas se nombran nombrando los grupos alquilo unidos al átomo de nitrógeno, seguido del sufijo - amina.
- Las amidas tienen una estructura general en la que un átomo de nitrógeno está unido a un átomo de carbono de carbonilo.

- Al igual que las aminas, se pueden usar varias reglas de nomenclatura para nombrar amidas, pero todas incluyen el uso del sufijo específico de clase -amida:
- Las aminas heterocíclicas son compuestos cíclicos con uno o más átomos de nitrógeno en el anillo.
Colaboradores y Atribuciones
CK-12 Foundation by Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson, and Jean Dupon.
Marisa Alviar-Agnew (Sacramento City College)
Libretexto: Los fundamentos de la química GOB (Ball et al.)
OpenStax
Wikipedia

