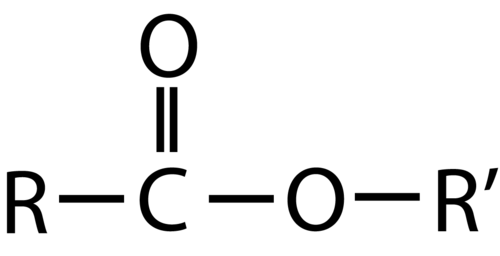9.7: Ácidos y Ésteres Carboxílicos
- Page ID
- 72517
- Describir la estructura y propiedades de los ácidos carboxílicos y ésteres.
- Nombrar ácidos carboxílicos comunes y ésteres.
El olor a vinagre es causado por la presencia de ácido acético, un ácido carboxílico, en el vinagre. El olor de los plátanos maduros y muchos otros frutos se debe a la presencia de ésteres, compuestos que se pueden preparar por reacción de un ácido carboxílico con un alcohol. Debido a que los ésteres no tienen enlaces de hidrógeno entre las moléculas, tienen presiones de vapor más bajas que los alcoholes y ácidos carboxílicos de los que se derivan.
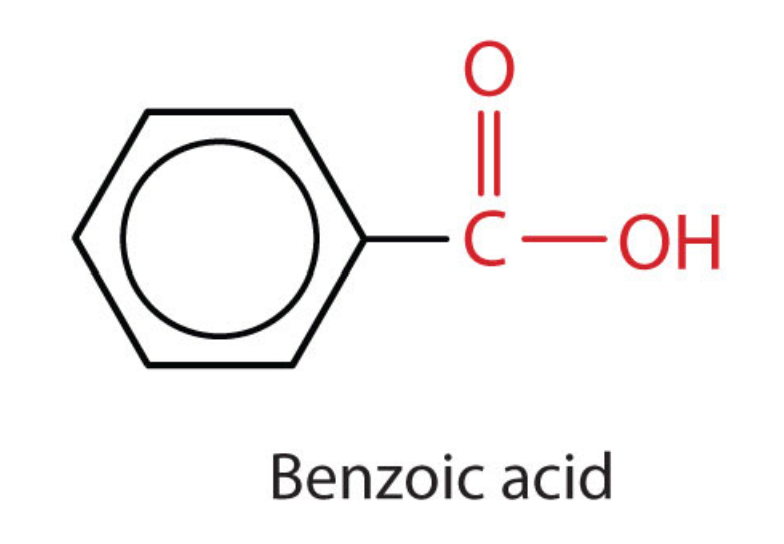
Tanto los ácidos carboxílicos como los ésteres contienen un grupo carbonilo con un segundo átomo de oxígeno unido al átomo de carbono en el grupo carbonilo por un enlace sencillo. En un ácido carboxílico, el segundo átomo de oxígeno también se une a un átomo de hidrógeno. En un éster, el segundo átomo de oxígeno se une a otro átomo de carbono. Los nombres para ácidos carboxílicos y ésteres incluyen prefijos que denotan las longitudes de las cadenas de carbono en las moléculas y se derivan siguiendo reglas de nomenclatura similares a las de ácidos inorgánicos y sales (ver estos ejemplos):
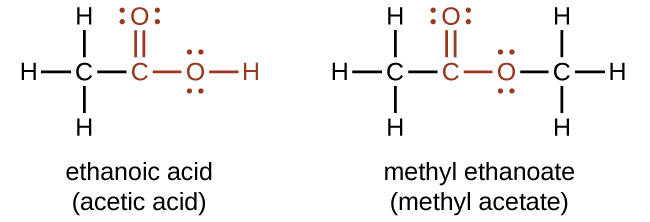
Los grupos funcionales para un ácido y para un éster se muestran en rojo en estas fórmulas.
Ácidos Carboxílicos
Los ácidos carboxílicos se encuentran ampliamente en la naturaleza, a menudo combinados con alcoholes u otros grupos funcionales, como en grasas, aceites y ceras. Son componentes de muchos alimentos, medicamentos y productos para el hogar (Figura\(\PageIndex{1}\)). No es sorprendente que muchos de ellos sean más conocidos por nombres comunes basados en palabras latinas y griegas que describen su fuente.

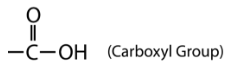
El grupo carboxilo contiene el\(\ce{C=O}\) del grupo carbonilo, estando el átomo de carbono también unido a un\(\left( \ce{-OH} \right)\) grupo hidroxilo. Un ácido carboxílico es un compuesto orgánico que contiene el grupo funcional carboxilo. La fórmula general para un ácido carboxílico se puede abreviar como\(\ce{R-COOH}\). El átomo de carbono del grupo carboxilo puede estar unido a un átomo de hidrógeno o a una cadena de carbono. El nombre de un ácido carboxílico es el siguiente: Nombrar el compuesto parental encontrando la cadena continua más larga que contiene el grupo carboxilo. Cambie el -e al final del nombre del alcano a ácido -oico.
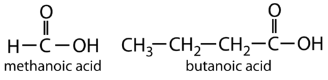
Los ácidos carboxílicos son ácidos débiles, lo que significa que no están 100% ionizados en agua. Generalmente solo alrededor del 1% de las moléculas de un ácido carboxílico disueltas en agua son ionizadas en un momento dado. Las moléculas restantes están no disociadas en solución.
Preparamos ácidos carboxílicos mediante la oxidación de aldehídos o alcoholes cuyo grupo funcional -OH se encuentra en el átomo de carbono al final de la cadena de átomos de carbono en el alcohol:
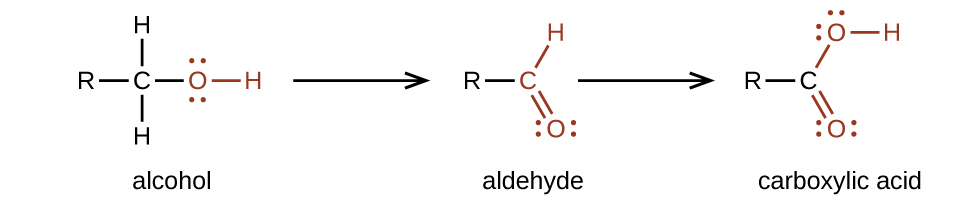
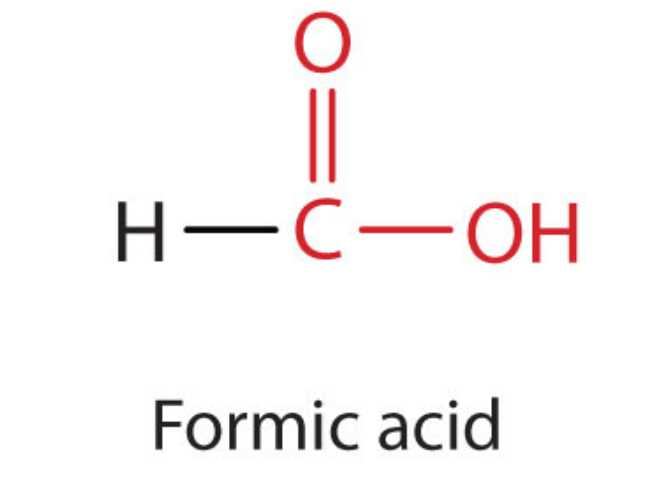
El ácido carboxílico más simple, el ácido fórmico (HCOOH, ácido metanoico), se obtuvo primero por destilación de hormigas (formica latina, que significa “hormiga”). Las picaduras de algunas hormigas inyectan ácido fórmico, y las picaduras de avispas y abejas contienen ácido fórmico (así como otros materiales venenosos).
El siguiente homólogo superior es el ácido acético (CH 3 COOH, ácido etanoico), que se elabora fermentando sidra y miel en presencia de oxígeno. Esta fermentación produce vinagre, una solución que contiene 4% — 10% de ácido acético, además de una serie de otros compuestos que se suman a su sabor. El ácido acético es probablemente el ácido débil más familiar utilizado en los laboratorios educativos e industriales de química.
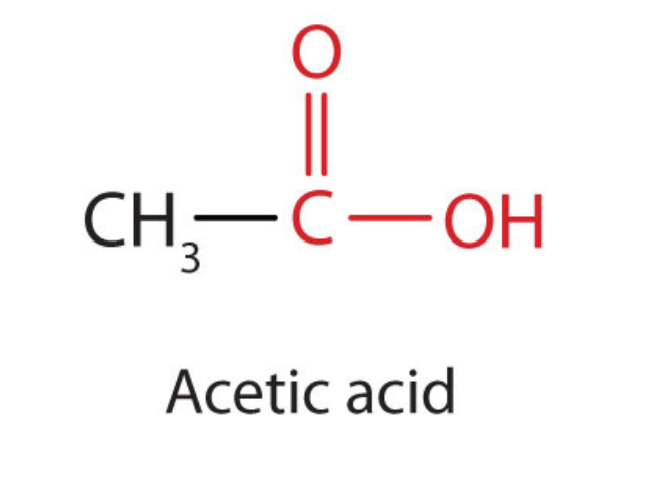
El ácido acético puro se solidifica a 16.6°C, solo ligeramente por debajo de la temperatura ambiente normal. En los laboratorios mal calentados de finales del siglo XIX y principios del XX en el norte de América del Norte y Europa, el ácido acético a menudo “se congeló” en el estante de almacenamiento. Por esa razón, el ácido acético puro (a veces llamado ácido acético concentrado) llegó a conocerse como ácido acético glacial, nombre que sobrevive hasta nuestros días.
El tercer homólogo, el ácido propiónico (CH 3 CH 2 COOH, ácido propiónico), rara vez se encuentra en la vida cotidiana. El cuarto homólogo, el ácido butírico (CH 3 CH 2 CH 2 COOH), es una de las sustancias más malolientes imaginables. Se encuentra en la mantequilla rancia y es uno de los ingredientes del olor corporal. Al reconocer cantidades extremadamente pequeñas de este y otros químicos, los sabuesos son capaces de rastrear a los fugitivos.
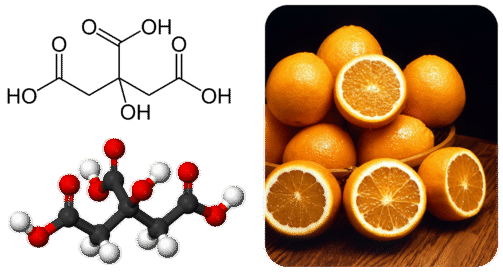
Muchos ácidos carboxílicos se encuentran naturalmente en plantas y animales. Los cítricos como las naranjas y los limones contienen ácido cítrico (Figura\(\PageIndex{4}\)). Los ácidos etanoico y cítrico se agregan frecuentemente a los alimentos para darles un sabor agrio.
Los ácidos benzoico, propanoico y sórbico se utilizan como conservantes de alimentos debido a su capacidad para matar microorganismos que pueden provocar el deterioro. Los ácidos metanoico y etanoico son ampliamente utilizados en la industria como puntos de partida para la fabricación de pinturas, adhesivos y recubrimientos.
Ésteres: El olor dulce de RCOOR'
Un éster es un compuesto orgánico que es un derivado de un ácido carboxílico en el que el átomo de hidrógeno del grupo hidroxilo ha sido reemplazado por un grupo alquilo. La estructura es el producto de un ácido carboxílico (la\(\ce{R}\) porción -) y un alcohol (la\(\ce{R'}\) porción -). A continuación se muestra la fórmula general para un éster.
El\(\ce{R}\) grupo puede ser una cadena de hidrógeno o de carbono. El\(\ce{R'}\) grupo debe ser una cadena carbonada ya que un átomo de hidrógeno convertiría a la molécula en un ácido carboxílico.
Los ésteres se producen por la reacción de ácidos con alcoholes. Por ejemplo, el éster acetato de etilo, CH 3 CO 2 CH 2 CH 3, se forma cuando el ácido acético reacciona con etanol:
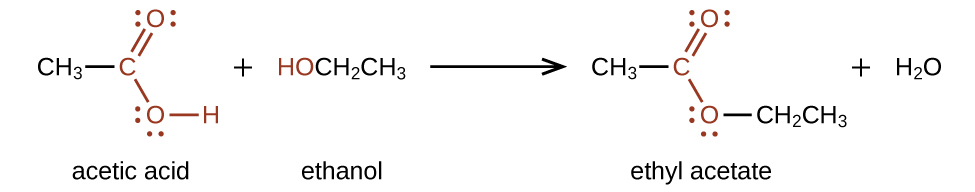
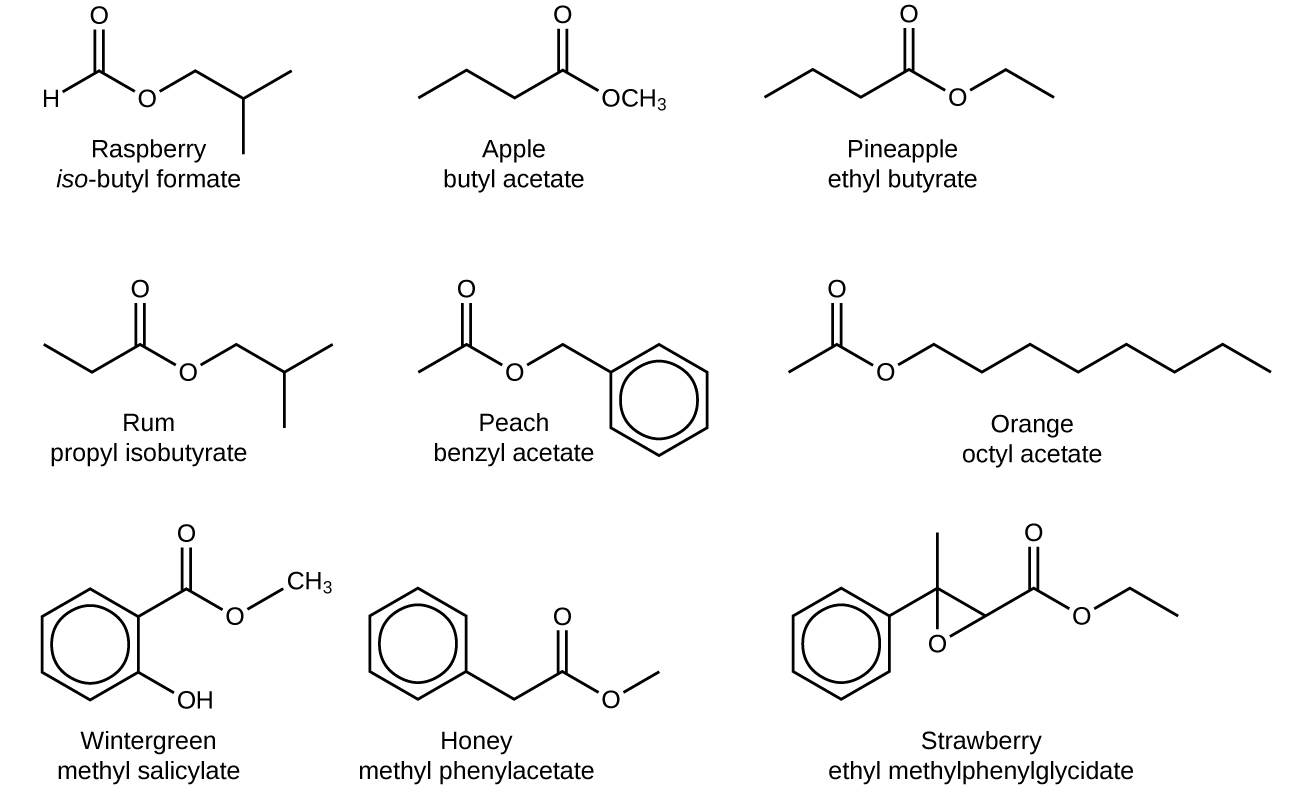
Los ésteres son compuestos muy interesantes, en parte porque muchos tienen olores y sabores muy agradables. (Recuerda, ¡nunca pruebes nada en el laboratorio de química!) Muchos ésteres ocurren de forma natural y contribuyen al olor de las flores y al sabor de los frutos. Otros ésteres se sintetizan industrialmente y se agregan a los productos alimenticios para mejorar su olor o sabor; es probable que si comes un producto cuyos ingredientes incluyen saborizantes artificiales, esos saborizantes sean ésteres. Estos son algunos ésteres y sus usos, gracias a sus olores, sabores, o ambos:
| Ester | Gusto/Huele | Ester | Gusto/Huele |
|---|---|---|---|
| hexanoato de alilo | piña | formiato de isobutilo | frambuesa |
| acetato de bencilo | pera | acetato de isobutilo | pera |
| Butanoato de butilo | piña | fenilacetato de metilo | miel |
| butanoato de etilo | plátano | caprilato de nonilo | naranja |
| hexanoato de etilo | piña | acetato de pentilo | manzana |
| heptanoato de etilo | albaricoque | etanoato de propilo | pera |
| pentanoato de etilo | manzana | isobutirato de propilo | ron |
Entre los ésteres naturales más importantes se encuentran las grasas (como manteca de cerdo, sebo y mantequilla) y los aceites (como los aceites de linaza, algodón y oliva), que son ésteres del alcohol trihidroxilado glicerina, C 3 H 5 (OH) 3, con ácidos carboxílicos grandes, como el ácido palmítico, CH 3 (CH 2) 14 CO 2 H, ácido esteárico, CH 3 (CH 2) 16 CO 2 H, y ácido oleico,\(\mathrm{CH_3(CH_2)_7CH=CH(CH_2)_7CO_2H}\). El ácido oleico es un ácido insaturado; contiene un\(\mathrm{C=C}\) doble enlace. Los ácidos palmítico y esteárico son ácidos saturados que no contienen dobles o triples enlaces.
Las grasas y aceites vegetales son ésteres de ácidos grasos de cadena larga y glicerol. Los ésteres de ácido fosfórico son de suma importancia para la vida.
Los ésteres son solventes comunes. El acetato de etilo se utiliza para extraer solutos orgánicos de soluciones acuosas, por ejemplo, para eliminar la cafeína del café. También se utiliza para quitar el esmalte de uñas y la pintura. El nitrato de celulosa se disuelve en acetato de etilo y acetato de butilo para formar lacas. El disolvente se evapora a medida que la laca se “seca”, dejando una fina película en la superficie. Los ésteres de alto punto de ebullición se utilizan como suavizantes (plastificantes) para plásticos quebradizos.
Resumen
- Un ácido carboxílico es un compuesto orgánico que contiene el grupo funcional carboxilo.
- La fórmula general para un ácido carboxílico se puede abreviar como\(\ce{R-COOH}\).
- Muchos ácidos carboxílicos se utilizan en la industria de alimentos y bebidas para aromatizar y/o como conservantes.
- Un éster tiene un grupo OR unido al átomo de carbono de un grupo carbonilo.
- Las grasas y aceites vegetales son ésteres de ácidos grasos de cadena larga y glicerol.
- Los ésteres se encuentran ampliamente en la naturaleza y generalmente tienen olores agradables y a menudo son responsables de las fragancias características de frutas y flores.
Colaboradores y Atribuciones
CK-12 Foundation by Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson, and Jean Dupon.
- Libretexto: Los fundamentos de la química GOB (Ball et al.)
- TextMap: Química inicial (Ball et al.)
- OpenStax