11.2: Ecuaciones Nucleares
- Page ID
- 71952
- Identificar partículas y energías comunes involucradas en reacciones nucleares.
- Escribir y equilibrar ecuaciones nucleares.
Los cambios de núcleos que resultan en cambios en sus números atómicos, números de masa o estados energéticos son reacciones nucleares. Para describir una reacción nuclear, utilizamos una ecuación que identifica los nucleidos involucrados en la reacción, sus números másticos y números atómicos, y las otras partículas involucradas en la reacción.
Tipos de Partículas en Reacciones Nucleares
Muchas entidades pueden estar involucradas en reacciones nucleares. Los más comunes son protones, neutrones, partículas alfa, partículas beta, positrones y rayos gamma, como se muestra en la Tabla\(\PageIndex{1}\).
Cuadro\(\PageIndex{1}\) A Resumen de los Nombres, Símbolos, Representaciones y Descripciones de las Partículas Más Comunes en Reacciones Nucleares.

Equilibrar las reacciones nucleares
Una ecuación de reacción química equilibrada refleja el hecho de que durante una reacción química, los enlaces se rompen y se forman, y los átomos se reordenan, pero los números totales de átomos de cada elemento se conservan y no cambian. Una ecuación equilibrada de reacción nuclear indica que hay un reordenamiento durante una reacción nuclear, pero de partículas subatómicas en lugar de átomos. Las reacciones nucleares también siguen las leyes de conservación, y se equilibran de dos maneras:
- La suma de los números de masa de los reactivos es igual a la suma de los números de masa de los productos.
- La suma de las cargas de los reactivos equivale a la suma de las cargas de los productos.
Si se conoce el número atómico y el número másico de todas las partículas menos una de las partículas en una reacción nuclear, podemos identificar la partícula equilibrando la reacción. Por ejemplo, podríamos determinar que\(\ce{^{17}_8O}\) es producto de la reacción nuclear de\(\ce{^{14}_7N}\) y\(\ce{^4_2He}\) si supiéramos que un protón,\(\ce{^1_1H}\), era uno de los dos productos. Ejemplo\(\PageIndex{1}\) muestra cómo podemos identificar un nucleido equilibrando la reacción nuclear.
Procesos de desintegración nuclear
La desintegración radiactiva implica la emisión de una partícula y/o energía a medida que un átomo cambia a otro. En la mayoría de los casos, el átomo cambia su identidad para convertirse en un nuevo elemento. Hay cuatro tipos diferentes de emisiones que ocurren.
Emisión Alfa
La \(\left( \alpha \right)\)desintegración alfa implica la liberación de iones de helio desde el núcleo de un átomo. Este ion consta de dos protones y dos neutrones y tiene una\(2+\) carga. La liberación de una\(\alpha\) -partícula produce un nuevo átomo que tiene un número atómico dos menor que el átomo original y un peso atómico que es cuatro menos. Una reacción típica de desintegración alfa es la conversión de uranio-238 en torio:
\[\ce{^{238}_{92}U} \rightarrow \ce{^{234}_{90}Th} + \ce{^4_2 \alpha}^+ \nonumber \]
Se observa una disminución de dos en el número atómico (uranio a torio) y una disminución de cuatro en el peso atómico (238 a 234). Por lo general la emisión no se escribe con número atómico y peso indicado ya que es una partícula común cuyas propiedades deben ser memorizadas. Muy a menudo la emisión alfa va acompañada de\(\left( \gamma \right)\) radiación gamma, una forma de liberación de energía. Muchos de los elementos más grandes de la tabla periódica son emisores alfa.
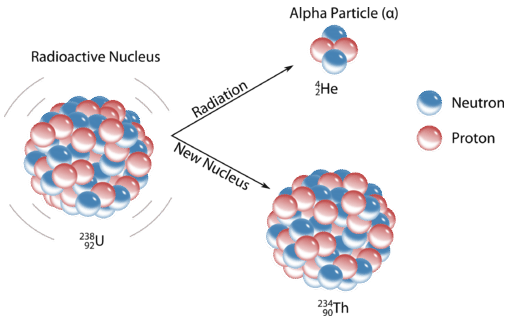
Los químicos a menudo usan los nombres isótopo padre e isótopo hijo para representar el átomo original y el producto que no sea la partícula alfa. En el ejemplo anterior,\[_{92}^{238}\textrm{U} \nonumber \] es el isótopo padre, y\[_{90}^{234}\textrm{Th} \nonumber \] es el isótopo hijo. Cuando un elemento se transforma en otro de esta manera, sufre desintegración radiactiva.
Escriba la ecuación nuclear que representa la desintegración radiactiva del radón-222 por emisión de partículas alfa e identifique el isótopo hijo.
Solución
El radón tiene un número atómico de 86, por lo que el isótopo padre se representa como\[_{86}^{222}\textrm{Rn} \nonumber \]
Representamos la partícula alfa como
\[_{2}^{4}\textrm{He} \nonumber \]
Utilice la resta (222 − 4 = 218 y 86 − 2 = 84) para identificar el isótopo hijo como polonio:
\[_{86}^{222}\textrm{Rn}\rightarrow \; _{2}^{4}\textrm{He}+\: _{84}^{218}\textrm{Th} \nonumber \]
Escribir la ecuación nuclear que representa la desintegración radiactiva del polonio-208 por emisión de partículas alfa e identificar el isótopo hijo.
- Contestar
-
\[_{80}^{208}\textrm{Po}\rightarrow \; _{2}^{4}\textrm{He}+\: _{82}^{204}\textrm{Pb} \nonumber \]
\[_{82}^{204}\textrm{Pb} \nonumber \]
Emisión Beta
La\(\left( \beta \right)\) desintegración beta es un proceso más complicado. A diferencia de la\(\alpha\) -emisión, que simplemente expulsa una partícula, la\(\beta\) -emisión implica la transformación de un neutrón en el núcleo en un protón y un electrón. El electrón es entonces expulsado del núcleo. En el proceso, el número atómico aumenta en uno mientras que el peso atómico permanece igual. Como es el caso de\(\alpha\) -emisiones,\(\beta\) -las emisiones suelen ir acompañadas de\(\gamma\) -radiación.
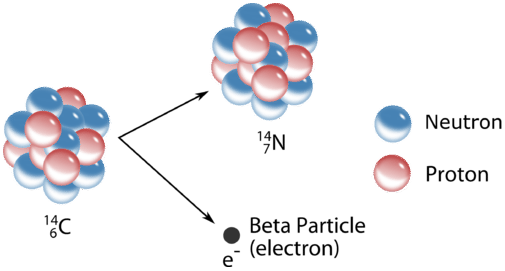
Un proceso típico de desintegración beta involucra carbono-14, a menudo utilizado en radiactivos. La reacción forma nitrógeno-14 y un electrón:
\[\ce{^{14}_6C} \rightarrow \ce{^{14}_7N} + \ce{^0_{-1}e} \nonumber \]
Nuevamente, la emisión beta suele ser indicada simplemente por la letra griega\(\beta\); la memorización del proceso es necesaria para seguir cálculos nucleares en los que la letra griega\(\beta\) aparece sin más notación.
Escriba la ecuación nuclear que representa la desintegración radiactiva del boro-12 por emisión de partículas beta e identifique el isótopo hijo. Se emite un rayo gamma simultáneamente con la partícula beta.
Solución
El isótopo padre es\[
Paul Flowers (University of North Carolina - Pembroke), Klaus Theopold (University of Delaware) and Richard Langley (Stephen F. Austin State University) with contributing authors. Textbook content produced by OpenStax College is licensed under a Creative Commons Attribution License 4.0 license. Download for free at http://cnx.org/contents/85abf193-2bd...a7ac8df6@9.110).
CK-12 Foundation by Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson, and Jean Dupon.
- TextMap: Beginning Chemistry (Ball et al.)
- TextMap: Chemistry The central Science (Brown et al.)

