11.3: Vida media y datación radioisotópica
- Page ID
- 71960
- Definir la vida media.
- Determinar la cantidad de sustancia radiactiva que queda después de un número dado de semividas.
- Definir una serie de desintegración radiactiva.
Si un isótopo dado es radiactivo o no es una característica de ese isótopo en particular. Algunos isótopos son estables indefinidamente, mientras que otros son radiactivos y se descomponen a través de una forma característica de emisión. A medida que pasa el tiempo, cada vez menos isótopo radiactivo estará presente, y el nivel de radiactividad disminuye. Un aspecto interesante y útil de la desintegración radiactiva es la vida media, que es la cantidad de tiempo que tarda la mitad de un isótopo radiactivo en descomponerse. La vida media de un isótopo radiactivo específico es constante; no se ve afectada por las condiciones y es independiente de la cantidad inicial de ese isótopo.
Por ejemplo, el cobalto-60, isótopo que emite rayos gamma utilizados para tratar el cáncer, tiene una vida media de 5.27 años (Figura\(\PageIndex{1}\)). En una fuente dada de cobalto-60, dado que la mitad de los\(\ce{^{60}_{27}Co}\) núcleos se descomponen cada 5.27 años, tanto la cantidad de material como la intensidad de la radiación emitida se cortan a la mitad cada 5.27 años. (Obsérvese que para una sustancia dada, la intensidad de radiación que produce es directamente proporcional a la tasa de descomposición de la sustancia y la cantidad de la sustancia.) Esto es como se esperaba para un proceso que sigue la cinética de primer orden. Por lo tanto, una fuente de cobalto-60 que se utiliza para el tratamiento del cáncer debe ser reemplazada regularmente para seguir siendo efectiva.
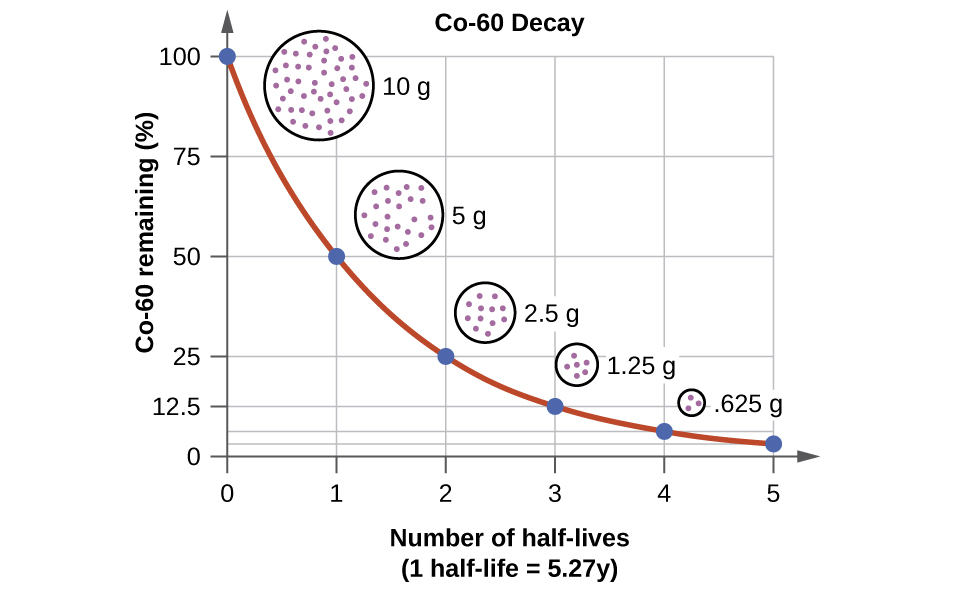
Podemos determinar la cantidad de un isótopo radiactivo que queda después de un número dado de semividas usando la siguiente expresión:
\[amount\; \: remaining\: =\: initial\:amount\times \left ( \frac{1}{2} \right )^{n} \nonumber \]
donde n es el número de vidas medias. Esta expresión funciona aunque el número de vidas medias no sea un número entero.
La vida media del fluor-20 es de 11.0 s. Si una muestra contiene inicialmente 5.00 g de fluor-20, ¿cuánto queda después de 44.0 s?
Solución
Si comparamos el tiempo que ha pasado a la vida media del isótopo, observamos que 44.0 s es exactamente 4 semividas, por lo que usando la expresión anterior, n = 4. Sustituir y resolver resultados en lo siguiente:
\[amount\; \: remaining\: =\: 5.00g\times \left ( \frac{1}{2} \right )^{4}\\ amount\; \: remaining\: =\: 5.00g\times \left ( \frac{1}{16} \right )\\ amount\; \: remaining\: =\: 0.313g \nonumber \]
Menos de un tercio de un gramo de fluor-20 queda.
La vida media del titanio-44 es de 60.0 y. Una muestra de titanio contiene 0.600 g de titanio-44. ¿Cuánto queda después de 240.0 y?
- Contestar
-
0.0375 g
Si hay 60 gramos de\(\ce{Np}\) -240 presentes, ¿cuánto\(\ce{Np}\) -240 quedará después de 4 horas? (\(\ce{Np}\)-240 tiene una vida media de 1 hora)
Solución
\(\ce{Np}\)-240 con una vida media de sólo 1 hora.

Después de 4 horas, solo\(3.75 \: \text{g}\) de nuestra\(60 \: \text{g}\) muestra original quedaría el isótopo radiactivo\(\ce{Np}\) -240.
Una muestra de\(\ce{Ac}\) -225 originalmente contenía 80 gramos y después de 50 días solo quedan 2.55 gramos del\(\ce{Ac}\) -225 original. ¿Cuál es la vida media de\(\ce{Ac}\) -225?
Contestar
10 días.
Se han determinado las vidas medias de muchos isótopos radiactivos y se ha encontrado que van desde semividas extremadamente largas de 10 mil millones de años hasta semividas extremadamente cortas de fracciones de segundo. Por ejemplo: la vida media de\(\ce{^{209}_{83}Bi}\) es 1.9 × 10 19 años;\(\ce{^{239}_{94}Ra}\) es 24,000 años;\(\ce{^{222}_{86}Rn}\) es 3.82 días; y elemente-111 (Rg para roentgenium) es 1.5 × 10 —3 segundos. La siguiente tabla ilustra las semividas de varios elementos seleccionados.
| Element | Número de masa (A) | Vida media | Element | Número de masa (A) | Half Life |
|---|---|---|---|---|---|
| Uranio | 238 | 4.5 mil millones de años | Californium | 251 | 800 años |
| Neptunio | 240 | 1 hora | Nobelium | 254 | 3 segundos |
| Plutonio | 243 | 5 horas | Carbono | 14 | 5730 años |
| Americio | 245 | 25 minutos | Carbono | 16 | 740 milisegundos |
Serie de desintegración de uranio
Los isótopos radiactivos naturales de los elementos más pesados caen en cadenas de desintegraciones sucesivas., o decae, y todas las especies en una cadena constituyen una familia radiactiva, o serie de desintegración radiactiva. Tres de estas series incluyen la mayoría de los elementos radiactivos naturalmente de la tabla periódica. Son la serie de uranio, la serie de actínidos y la serie de torio. (Figura\(\PageIndex{2}\)). En las tres series, el producto final es un isótopo estable de plomo.
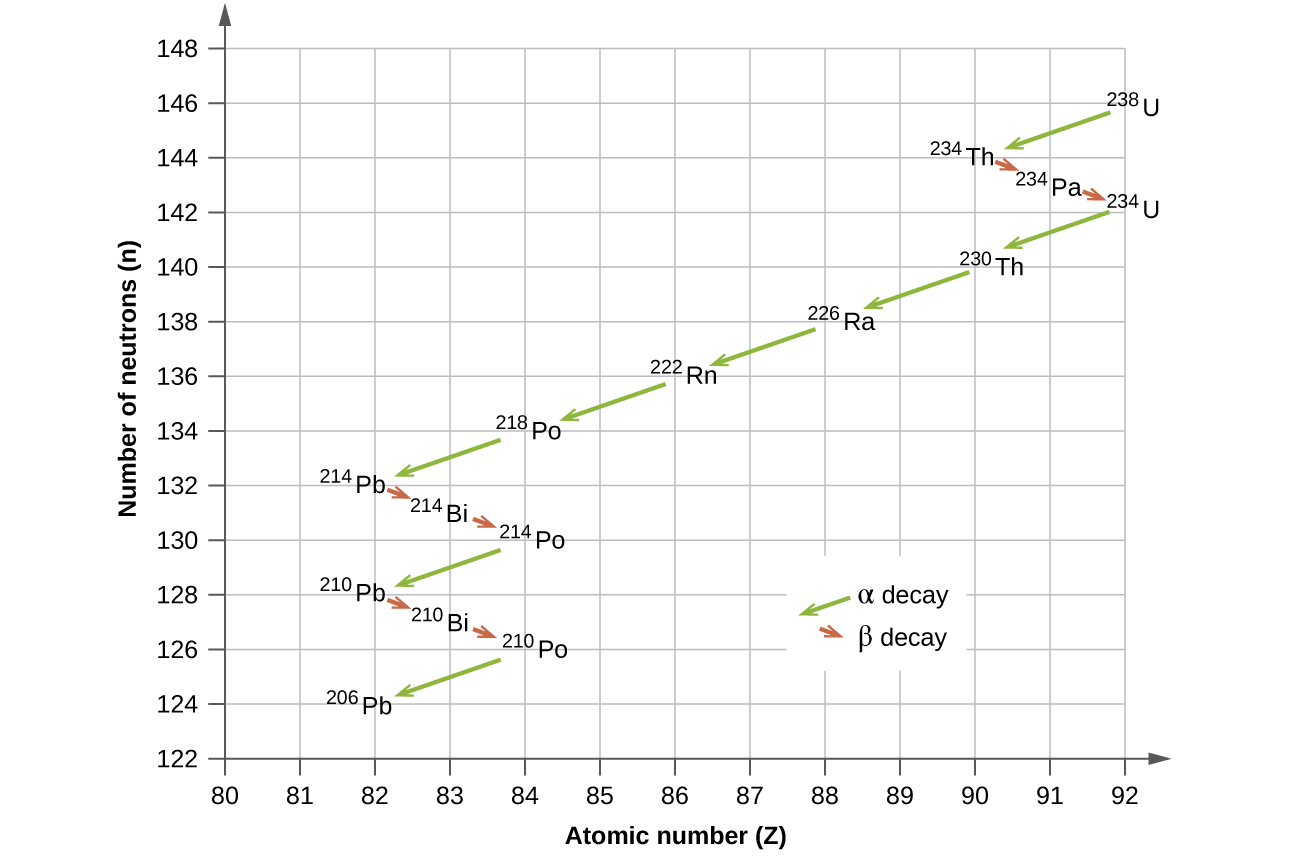
Datación radiactiva
La datación radiactiva es un proceso mediante el cual se determina la edad aproximada de un objeto mediante el uso de ciertos nucleidos radiactivos. Por ejemplo, el carbono-14 tiene una vida media de 5,730 años y se utiliza para medir la edad del material orgánico. La proporción de carbono-14 a carbono-12 en los seres vivos permanece constante mientras el organismo está vivo porque el carbono-14 fresco ingresa al organismo cada vez que consume nutrientes. Cuando el organismo muere, este consumo se detiene, y no se agrega nuevo carbono-14 al organismo. A medida que pasa el tiempo, la proporción de carbono-14 a carbono-12 en el organismo disminuye gradualmente, debido a que el carbono-14 se descompone radioactivamente mientras que el carbono-12 es estable. El análisis de esta proporción permite a los arqueólogos estimar la edad de los organismos que estaban vivos hace muchos miles de años. Por ejemplo, con la vida media de\(\ce{^{14}_6C}\) ser de 5730 años, si la\(\ce{^{14}_6C : ^{12}_6C}\) proporción en un objeto de madera que se encuentra en una excavación arqueológica es la mitad de lo que es en un árbol vivo, esto indica que el objeto de madera tiene 5730 años de antigüedad.
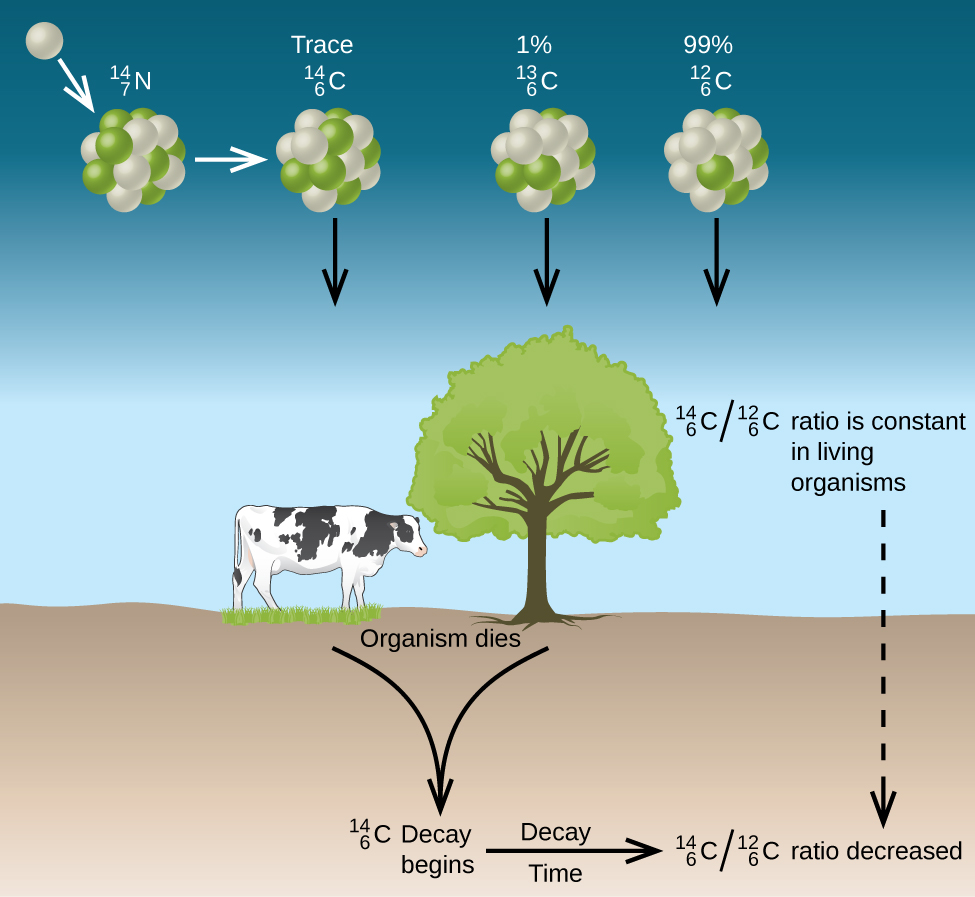
La datación C-14 tiene limitaciones. Por ejemplo, una muestra puede tener datación C-14 si tiene aproximadamente de 100 a 50,000 años. Antes o después de este rango, hay muy poco isótopo para ser detectado. Las sustancias deben haber obtenido C-14 de la atmósfera. Por esta razón, las muestras acuáticas no pueden ser efectivamente fechadas C-14. Por último, la precisión de la datación C-14 se ha visto afectada por las pruebas de armas nucleares en atmósfera. Las bombas de fisión se encienden para producir más C-14 artificialmente. Las muestras analizadas durante y después de este periodo deben ser verificadas con otro método de datación (anillos isotópicos o arbóreos).
Para calcular la edad de una sustancia usando isotópico datación, usa la siguiente ecuación:
\[ \text{how old (time)} = n \times t_{1/2} \nonumber \]
donde\(n\) es el número de vidas medias y\(t_{1/2}\) es la vida media (en el tiempo).
¿Cuánto tiempo tardarán 18.0 gramos de Ra-226 en decairse para dejar un total de 2.25 gramos? Ra-226 tiene una vida media de 1600 años.
Solución
18.0g ⇒ 9.0g ⇒ 4.5g ⇒ 2.25g, esto es tres vidas medias
\[ \text{how old (time)} = 3 \times 1600\, years \nonumber \]
Este proceso de descomposición tarda 4800 años en ocurrir.
Un hito químico histórico nacional -American Chemical Society
Dedic ated en la Universidad de Chicago el 10 de octubre de 2016.
ated en la Universidad de Chicago el 10 de octubre de 2016. 
En 1946, Willard Libby propuso un método innovador para fechar materiales orgánicos midiendo su contenido de carbono-14, un isótopo radiactivo recién descubierto de carbono. Conocido como datación por radiocarbono, este método proporciona estimaciones objetivas de edad para objetos basados en carbono que se originaron a partir de organismos vivos. La “revolución del radiocarbono” que fue posible gracias al descubrimiento de Libby benefició enormemente los campos de la arqueología y la geología al permitir que los practicantes desarrollaran cronologías históricas más precisas a través de la geografía y las culturas..
Willard F. Libby (derecha), el fisicoquímico que concibió la datación por radiocarbono, con el estudiante de posgrado Ernest Anderson.
Archivo Fotográfico de la Universidad de Chicago, apf1-03868, Centro de Investigación de Colecciones Especiales, Biblioteca de la Universidad de Chicago.
Ir al enlace de abajo para más detalles
www.acs.org/content/acs/es/education/whatischemistry/landmarks/radiocarbon-dating.html
Datación radiactiva mediante nucleidos distintos del carbono-14
La datación radiactiva también puede utilizar otros nucleidos radiactivos con vidas medias más largas para fechar eventos más antiguos. Una ingeniosa aplicación de estudios de vida media estableció una nueva ciencia para determinar las edades de los materiales mediante cálculos de semivida. Para la datación geológica, se puede utilizar la descomposición de\(\ce{U}\) -238. La vida media de\(\ce{U}\) -238 es\(4.5 \times 10^9\) años. El producto final de la descomposición de\(\ce{U}\) -238 es\(\ce{Pb}\) -206. Después de una vida media, una muestra de 1.00 gramos de uranio habrá descompuesto a 0.50 gramos de\(\ce{U}\) -238 y 0.43 gramos de\(\ce{Pb}\) -206. Al comparar la cantidad de\(\ce{U}\) -238 con la cantidad de\(\ce{Pb}\) -206 en una muestra de mineral de uranio, se puede estimar la edad del mineral. Las estimaciones actuales para la edad de la corteza terrestre a partir de este método son de 4 mil millones de años. Este enfoque de radiactividad también se puede utilizar para detectar cosechas falsas de vino.
Los isótopos con vidas medias más cortas se utilizan para fechar muestras más recientes. Por ejemplo, el tritio (t 1/2 =12.3 años) puede fechar muestras dentro de un rango de edad de 1-100 años. Químicos y geólogos utilizan la datación por tritio para determinar la edad del agua (oceánica y fresca). Además, la datación por tritio puede ser útil para determinar la edad de los vinos y brandies.
K-40 decae por emisión de positrones y captura de electrones para formar Ar-40 con una vida media de 1.25 mil millones de años. Si se tritura una muestra de roca y se mide la cantidad de gas Ar-40 que escapa, la determinación de la relación Ar-40:K-40 produce la edad de la roca. Otros métodos, como la datación rubidio-estroncio (Rb-87 decae en Sr-87 con una vida media de 48.800 millones de años), operan bajo el mismo principio. Para estimar el límite inferior para la edad de la tierra, los científicos determinan la edad de diversas rocas y minerales, asumiendo que la tierra es más antigua que las rocas y minerales más antiguos de su corteza. A partir de 2014, las rocas más antiguas conocidas en la tierra son los circones Jack Hills de Australia, encontrados por uranio-plomo que datan de casi 4.4 mil millones de años.
Resumen
- Los procesos radiactivos naturales se caracterizan por una vida media, el tiempo que tarda la mitad del material en descomponerse radiactivamente.
- La cantidad de material sobrante después de un cierto número de vidas medias se puede determinar usando la siguiente expresión:
\[amount\; \: remaining\: =\: initial\:amount\times \left ( \frac{1}{2} \right )^{n} \nonumber \]
donde n es el número de vidas medias.
- \(\ce{C}\)-14 procedimientos de datación se han utilizado para determinar la edad de los artefactos orgánicos. Su vida media es de aproximadamente 5700 años.
Colaboradores y Atribuciones
- TextMap: Beginning Chemistry (Ball et al.)
CK-12 Foundation by Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson, and Jean Dupon.
Paul Flowers (University of North Carolina - Pembroke), Klaus Theopold (University of Delaware) and Richard Langley (Stephen F. Austin State University) with contributing authors. Textbook content produced by OpenStax College is licensed under a Creative Commons Attribution License 4.0 license. Download for free at http://cnx.org/contents/85abf193-2bd...a7ac8df6@9.110).
- American Chemical Society-Chemical Landmarks

