14.1: Agua - Algunas Propiedades Únicas
- Page ID
- 72435
Describir las diferentes propiedades del agua en relación con su polaridad y capacidad para formar enlaces de hidrógeno.
Mirar más de cerca: el agua, el líquido más importante
La Tierra es el único cuerpo conocido en nuestro sistema solar que tiene agua líquida que existe libremente en su superficie. Eso es algo bueno porque la vida en la Tierra no sería posible sin la presencia de agua líquida. El agua es una molécula simple que consiste en un átomo de oxígeno unido a dos átomos de hidrógeno diferentes (Figura\(\PageIndex{1}\)). Debido a la mayor electronegatividad del átomo de oxígeno, los enlaces son covalentes polares (enlaces polares). El átomo de oxígeno atrae los electrones compartidos de los enlaces covalentes en una extensión significativamente mayor que los átomos de hidrógeno. Como resultado, el átomo de oxígeno requiere una carga negativa parcial\(\left( \delta - \right)\), mientras que los átomos de hidrógeno adquieren cada uno una carga positiva parcial\(\left( \delta + \right)\). La molécula adopta una estructura doblada debido a los dos pares solitarios de electrones en el átomo de oxígeno. El ángulo de\(\ce{H-O-H}\) enlace es aproximadamente\(105^\text{o}\), ligeramente menor que el ideal\(109.5^\text{o}\) de una órbita atómica\(sp^3\) hibridada.La forma doblada de la molécula de agua es crítica porque los\(\ce{O-H}\) enlaces polares no se cancelan entre sí y la molécula en su conjunto es polar.
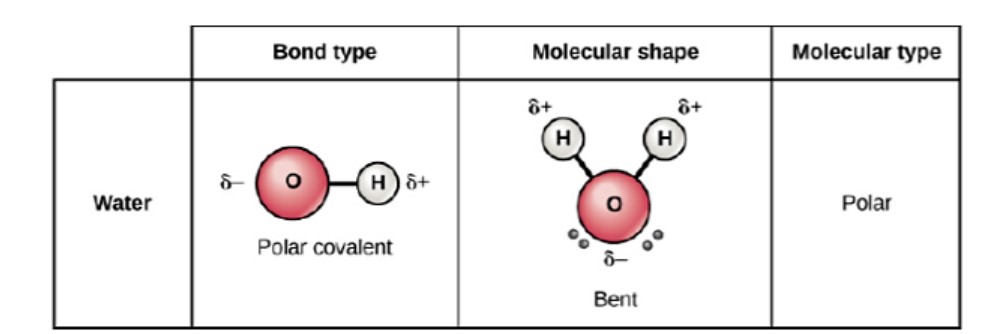
Enlaces de hidrógeno
Debido a la polaridad del agua, cada molécula de agua atrae a otras moléculas de agua ya que los extremos de las moléculas con carga de oposición se atraen entre sí. Cuando esto sucede, se produce una interacción débil entre el extremo positivo de hidrógeno de una molécula y el extremo negativo de oxígeno de otra molécula. Esta interacción se llama un enlace de hidrógeno. Este enlace de hidrógeno contribuye a las siguientes propiedades únicas del agua.
1. El agua es el solvente universal
2. Existe en la naturaleza como sólido, líquido y gas
3. La densidad del hielo es menor que el agua líquida
4. El agua tiene una alta capacidad calorífica
5. El agua tiene un alto calor de vaporización
6. El agua existe como líquido a temperatura ambiente Es importante señalar aquí que incluso solo nos estamos enfocando en el agua en este libro de texto, los enlaces de hidrógeno también se producen en otras sustancias que tienen moléculas polares.
Densidad del agua
El agua líquida es un fluido. Los enlaces de hidrógeno en el agua líquida se rompen y se reforman constantemente a medida que las moléculas de agua caen unas junto a otras A medida que el agua se enfría, su movimiento molecular se ralentiza y las moléculas se acercan gradualmente entre sí. La densidad de cualquier líquido aumenta a medida que disminuye su temperatura. Para la mayoría de los líquidos, esto continúa a medida que el líquido se congela y el estado sólido es más denso que el estado líquido. Sin embargo, el agua se comporta de manera diferente (Tabla\(\PageIndex{1}\)). De hecho, alcanza su densidad más alta aproximadamente a aproximadamente\(4^\text{o} \text{C}\).
| Temperatura\(\left( ^\text{o} \text{C} \right)\) | Densidad\(\left( \text{g/cm}^3 \right)\) |
|---|---|
| \ (\ left (^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; text-align:center;” class="lt-chem-152224">100 (líquido) | \ (\ left (\ text {g/cm} ^3\ right)\)” style="vertical-align:middle; text-align:center;” class="lt-chem-152224">0.9584 |
| \ (\ left (^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; text-align:center;” class="lt-chem-152224">50 | \ (\ left (\ text {g/cm} ^3\ right)\)” style="vertical-align:middle; text-align:center;” class="lt-chem-152224">0.9881 |
| \ (\ left (^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; text-align:center;” class="lt-chem-152224">25 | \ (\ left (\ text {g/cm} ^3\ right)\)” style="vertical-align:middle; text-align:center;” class="lt-chem-152224">0.9971 |
| \ (\ left (^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; text-align:center;” class="lt-chem-152224">10 | \ (\ left (\ text {g/cm} ^3\ right)\)” style="vertical-align:middle; text-align:center;” class="lt-chem-152224">0.9997 |
| \ (\ left (^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; text-align:center;” class="lt-chem-152224">4 | \ (\ left (\ text {g/cm} ^3\ right)\)” style="vertical-align:middle; text-align:center;” class="lt-chem-152224">1.0000 |
| \ (\ left (^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; text-align:center;” class="lt-chem-152224">0 (líquido) | \ (\ left (\ text {g/cm} ^3\ right)\)” style="vertical-align:middle; text-align:center;” class="lt-chem-152224">0.9998 |
| \ (\ left (^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; text-align:center;” class="lt-chem-152224">0 (sólido) | \ (\ left (\ text {g/cm} ^3\ right)\)” style="vertical-align:middle; text-align:center;” class="lt-chem-152224">0.9168 |
En medio\(4^\text{o} \text{C}\) y\(0^\text{o} \text{C}\), la densidad disminuye gradualmente a medida que los enlaces de hidrógeno comienzan a formar una red caracterizada por una estructura generalmente hexagonal con espacios abiertos en medio de los hexágonos (Figura\(\PageIndex{2}\)).
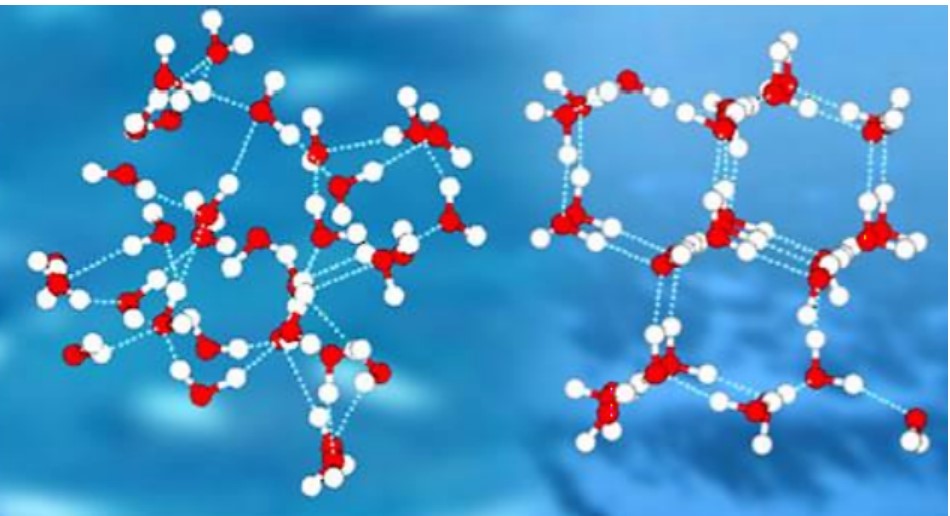
El hielo es menos denso que el agua líquida y así flota. Los estanques o lagos comienzan a congelarse en la superficie, más cerca del aire frío. Se forma una capa de hielo, pero no se hunde como lo haría si el agua no tuviera esta estructura única dictada por su forma, polaridad y enlaces de hidrógeno. Si el hielo se hundiera mientras se congelaba, lagos enteros se congelarían sólidos. Como el hielo no se hunde, el agua líquida permanece bajo el hielo durante todo el invierno. Esto es importante, ya que los peces y otros organismos son capaces de sobrevivir durante el invierno. El hielo es uno de los pocos sólidos que es menos denso que su forma líquida.
Capacidad de Solvación del Agua
El agua generalmente disuelve muchos compuestos iónicos y moléculas polares. Las moléculas no polares como las que se encuentran en la grasa o el aceite no se disuelven en el agua. Primero examinaremos el proceso que ocurre cuando un compuesto iónico como la sal de mesa (cloruro de sodio) se disuelve en agua.
El agua es atraída por el cristal de cloruro de sodio porque el agua es polar y tiene un final tanto positivo como negativo. Los iones de sodio cargados positivamente en el cristal atraen el extremo de oxígeno de las moléculas de agua porque son parcialmente negativas. Los iones cloruro cargados negativamente en el cristal atraen el extremo de hidrógeno de las moléculas de agua porque son parcialmente positivas. La acción de las moléculas polares de agua descompone la red cristalina (ver Figura\(\PageIndex{3}\)).

Después de separarse del cristal, los iones individuales son rodeados por partículas de disolvente en un proceso llamado solvatación. Tenga en cuenta que los\(\ce{Na^+}\) iones individuales están rodeados por moléculas de agua con el átomo de oxígeno orientado cerca del ion positivo. Asimismo, los iones cloruro están rodeados por moléculas de agua con la orientación opuesta. La hidratación es el proceso de partículas de soluto que están rodeadas por moléculas de agua dispuestas de manera específica. La hidratación ayuda a estabilizar las soluciones acuosas al evitar que los iones positivos y negativos se vuelvan a unir y formen un precipitado.
El azúcar de mesa es sacarosa\(\left( \ce{C_{12}H_{22}O_{11}} \right)\) y es un ejemplo de un compuesto molecular. El azúcar sólido consiste en moléculas individuales de azúcar unidas por fuerzas atractivas intermoleculares. Cuando el agua disuelve el azúcar, separa las moléculas individuales de azúcar alterando las fuerzas atractivas, pero no rompe los enlaces covalentes entre los átomos de carbono, hidrógeno y oxígeno. Las moléculas de azúcar disueltas también están hidratadas, pero sin una orientación tan distinta a las moléculas de agua como en el caso de los iones. Las moléculas de azúcar contienen muchos\(\ce{-OH}\) grupos que pueden formar enlaces de hidrógeno con las moléculas de agua, ayudando a formar la solución de sacarosa.
La naturaleza anfótera del agua
El agua es anfótera: tiene la capacidad de actuar como ácido o como base en reacciones químicas. Según la definición de Brønsted-Lowry, un ácido es un donante de protones (H +) y una base es un aceptor de protones. Al reaccionar con un ácido más fuerte, el agua actúa como base; al reaccionar con una base más fuerte, actúa como un ácido. Por ejemplo, el agua recibe un ion H + de HCl cuando se forma ácido clorhídrico:
- HCl (ácido) + H 2 O (base) H 3 O + + Cl −
En la reacción con amoníaco, NH 3, el agua dona un ion H +, y así actúa como un ácido:
- NH 3 (base) + H 2 O (ácido) NH + 4 + OH −
Alta capacidad calorífica y calor específico del agua
Diferentes sustancias responden al calor de diferentes maneras. Si una silla de metal se sienta al sol brillante en un día caluroso, puede llegar a ser bastante calurosa al tacto. Una masa igual de agua en el mismo sol no se volverá casi tan caliente. Tabla\(\PageIndex{2}\) lista calores específicos de diversas sustancias en comparación con el agua.El agua tiene la mayor capacidad calorífica específica de cualquier líquido. La alta capacidad calorífica del agua es una propiedad causada por los enlaces de hidrógeno entre las moléculas de agua. El calor específico se define como la cantidad de calor que un gramo de una sustancia debe absorber o perder para cambiar su temperatura en un grado Celsius. Para el agua, esta cantidad es de 1 cal/g o C. Las unidades para calor específico pueden estar en las unidades SI de julios por gramo por grado\(\left( \text{J/g}^\text{o} \text{C} \right)\) o calorías por gramo por grado\(\left( \text{cal/g}^\text{o} \text{C} \right)\). Este texto se utilizará\(\text{J/g}^\text{o} \text{C}\) para calor específico.

El agua tarda mucho en calentarse y mucho tiempo enfriarse. De hecho, la capacidad calorífica específica del agua es aproximadamente cinco veces más que la de la arena. Esto explica por qué la tierra se enfría más rápido que el mar. Los climas costeros son mucho más moderados que los climas interiores debido a la presencia del océano. El agua en lagos u océanos absorbe el calor del aire en los días calurosos y lo libera de nuevo al aire en los días fríos. El agua se utiliza como refrigerante para maquinaria porque es capaz de absorber grandes cantidades de calor (Figura\(\PageIndex{4}\)). Debido a su alta capacidad calorífica, los animales de sangre caliente utilizan el agua para dispersar el calor de manera más uniforme y mantener la temperatura en sus cuerpos: actúa de manera similar al sistema de enfriamiento de un automóvil, transportando calor de lugares cálidos a lugares fríos, haciendo que el cuerpo mantenga una temperatura más uniforme.
| Sustancia | Calor Específico\(\left( \text{J/g}^\text{o} \text{C} \right)\) |
|---|---|
| Agua (l) | \ (\ left (\ text {J/g} ^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; text-align:center;” class="lt-chem-152224">4.18 |
| Agua (s) | \ (\ left (\ text {J/g} ^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; text-align:center;” class="lt-chem-152224">2.06 |
| Agua (g) | \ (\ left (\ text {J/g} ^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; text-align:center;” class="lt-chem-152224">1.87 |
| Amoníaco (g) | \ (\ left (\ text {J/g} ^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; text-align:center;” class="lt-chem-152224">2.09 |
| Etanol (l) | \ (\ left (\ text {J/g} ^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; text-align:center;” class="lt-chem-152224">2.44 |
| Aluminio (s) | \ (\ left (\ text {J/g} ^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; text-align:center;” class="lt-chem-152224">0.897 |
| Carbono, grafito (s) | \ (\ left (\ text {J/g} ^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; text-align:center;” class="lt-chem-152224">0.709 |
| Cobre (s) | \ (\ left (\ text {J/g} ^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; text-align:center;” class="lt-chem-152224">0.385 |
| Oro (s) | \ (\ left (\ text {J/g} ^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; text-align:center;” class="lt-chem-152224">0.129 |
| Hierro (s) | \ (\ left (\ text {J/g} ^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; text-align:center;” class="lt-chem-152224">0.449 |
| Plomo (s) | \ (\ left (\ text {J/g} ^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; text-align:center;” class="lt-chem-152224">0.129 |
| Mercurio (l) | \ (\ left (\ text {J/g} ^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; text-align:center;” class="lt-chem-152224">0.140 |
| Plata (s) | \ (\ left (\ text {J/g} ^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; text-align:center;” class="lt-chem-152224">0.233 |
Alto Calor de Vaporización del Agua
El agua en su forma líquida tiene una temperatura de punto de ebullición inusualmente alta, un valor cercano a 100°C.Como resultado de la red de enlaces de hidrógeno presente entre las moléculas de agua, se requiere un alto aporte de energía para transformar un gramo de agua líquida en vapor de agua, un requisito de energía llamado calor de vaporización. El agua tiene un valor de calor de vaporización de 40.65 kJ/mol. Se requiere una cantidad considerable de energía térmica (586 calorías) para lograr este cambio en el agua. Este proceso ocurre en la superficie del agua. A medida que el agua líquida se calienta, los enlaces de hidrógeno dificultan la separación de las moléculas de agua entre sí, lo que se requiere para que entre en su fase gaseosa (vapor). Como resultado, el agua actúa como disipador de calor, o depósito de calor, y requiere mucho más calor para hervir que un líquido como el etanol (alcohol de grano), cuyo enlace de hidrógeno con otras moléculas de etanol es más débil que el enlace de hidrógeno del agua.
El hecho de que se necesiten romper los enlaces de hidrógeno para que el agua se evapore significa que se utiliza una cantidad sustancial de energía en el proceso. A medida que el agua se evapora, la energía es absorbida por el proceso, enfriando el ambiente donde se está produciendo la evaporación. En muchos organismos vivos, entre ellos los humanos, la evaporación del sudor, que es 90 por ciento de agua, permite que el organismo se enfríe para que se pueda mantener la homeostasis de la temperatura corporal.
Resumen
- La polaridad del agua y su capacidad de enlace de hidrógeno contribuye a sus propiedades únicas.
- Las moléculas de soluto iónico están hidratadas (rodeadas por moléculas de disolvente en una orientación específica).
- El hielo es menos denso que el agua líquida debido a los espacios en la estructura intermolecular del hielo no presentes en el agua.
- La capacidad calorífica es la cantidad de calor requerida para elevar la temperatura de un objeto por\(1^\text{o} \text{C}\)).
- El calor específico de una sustancia es la cantidad de energía requerida para elevar la temperatura de 1 gramo de la sustancia por\(1^\text{o} \text{C}\).
- La disociación de las moléculas de agua líquida, que cambia la sustancia a un gas, requiere de mucha energía.
Colaboradores y Atribuciones
CK-12 Foundation by Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson, and Jean Dupon.
- Boundless: The Chemical Foundation of Life
- Libretext: Introduction to Environmental Science (Zendher et al.)
- TextMap: Introductory Chemistry (Tro)

