14.2: El agua en la naturaleza
- Page ID
- 72456
- Conocer la distribución del agua terrestre.
- Describir el ciclo del agua (hidrológico).
- Conoce los diferentes contaminantes naturales del agua
La influencia del agua en el mundo que nos rodea se ve afectada por sus propiedades únicas algunas de las cuales fueron discutidas en la sección anterior. Sin agua, la vida podría no ser capaz de existir en la Tierra, y ciertamente no tendría la tremenda complejidad y diversidad que vemos.
Distribución del Agua de la Tierra
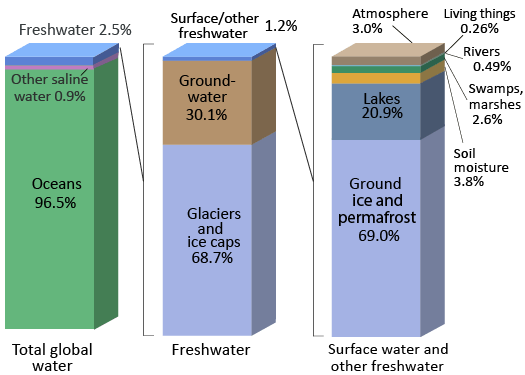
Los océanos de la Tierra contienen 97% del agua del planeta, por lo que solo 3% es agua dulce, agua con bajas concentraciones de sales (Figura\(\PageIndex{1}\)). La mayor parte del agua de la Tierra se puede clasificar como salina (o que contiene sal). La mayor parte del agua dulce está atrapada como hielo en los vastos glaciares y capas de hielo de Groenlandia. Un lugar de almacenamiento de agua como un océano, glaciar, estanque o incluso la atmósfera se conoce como un reservorio.
El ciclo del agua (hidrológico) y los contaminantes naturales
Debido a que el agua de la Tierra está presente en los tres estados, puede entrar en una variedad de ambientes alrededor del planeta. El movimiento del agua alrededor de la superficie de la Tierra es el ciclo del agua (Figura\(\PageIndex{2}\)).
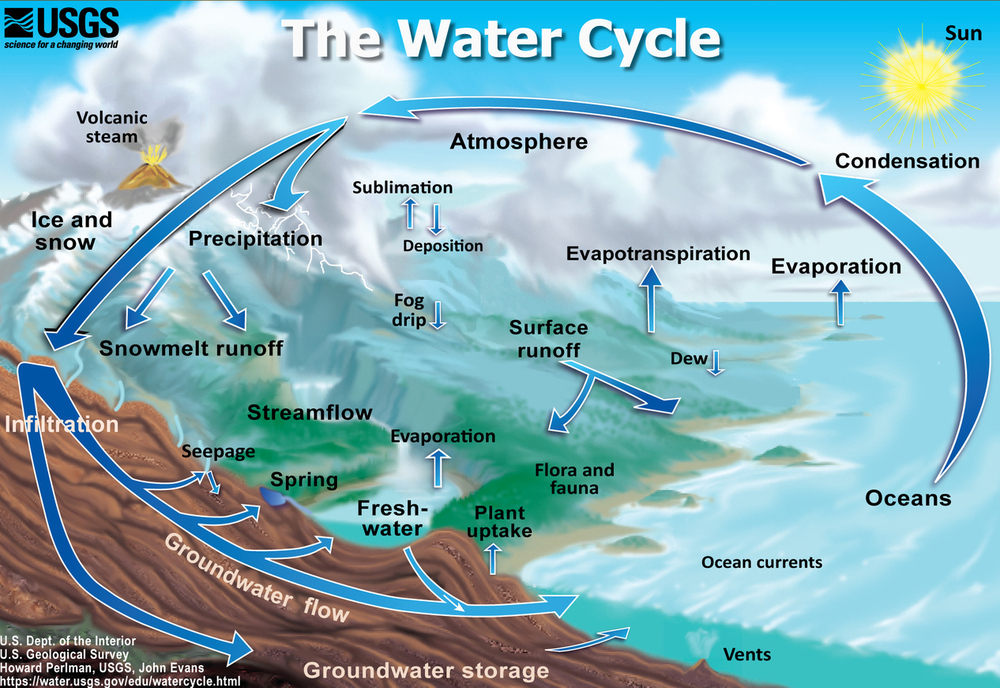
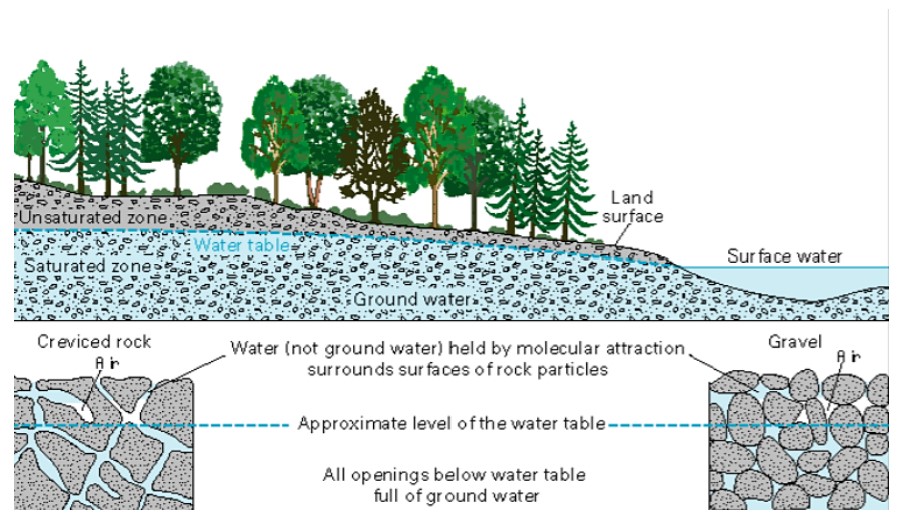
El agua cambia de un líquido a un gas por evaporación para convertirse en vapor de agua. La energía del Sol puede evaporar el agua de la superficie del océano o de lagos, arroyos o charcos en tierra. Solo las moléculas de agua se evaporan; las sales permanecen en el océano o en un reservorio de agua dulce. El vapor de agua permanece en la atmósfera hasta que sufre condensación y luego precipitación. La precipitación puede ser lluvia, aguanieve, granizo o nieve. En la superficie, el agua o el agua derretida, pueden eventualmente evaporarse y volver a entrar en la atmósfera. Una cantidad significativa de agua se infiltra en el suelo. El agua puede filtrarse a través de la suciedad y la roca debajo del suelo a través de poros infiltrándose en el suelo para entrar en el sistema de agua subterránea de la Tierra (Figura\(\PageIndex3}\)) El agua subterránea ingresa a los acuíferos que son cuerpos de roca o sedimentos que almacenan (y producen) grandes cantidades de agua utilizable en sus poros. Alternativamente, el agua puede llegar a la superficie a través de manantiales o encontrar su camino de regreso a los océanos.
Sustancias presentes en aguas naturales
Las cantidades de agua presentes en la atmósfera y en tierra (como escorrentía superficial, lagos y arroyos) son lo suficientemente grandes como para convertirla en un agente significativo en el transporte de sustancias entre la litosfera (la superficie rígida de la tierra) y los océanos. El agua interactúa tanto con la atmósfera como con la litosfera (la superficie rígida de la tierra) adquiriendo solutos de cada uno, y así proporciona el principal vínculo químico entre estos dos reinos. Las diversas transformaciones sufridas por el agua a través de las diferentes etapas del ciclo hidrológico actúan para transportar tanto sustancias disueltas como particuladas entre diferentes ubicaciones geográficas.
La Ley de Agua Potable Segura define el término "contaminante" como cualquier sustancia o materia física, química, biológica o radiológica en el agua. Por lo tanto, la ley define “contaminante” de manera muy amplia como cualquier otra cosa que no sean moléculas de agua.
Gases
El dióxido de carbono en el agua natural crea un fenómeno interesante. El agua de lluvia está saturada de CO 2 y disuelve las calizas. Cuando se pierde CO 2 debido a cambios de temperatura o escape de gotas de agua, se produce la reacción inversa. El sólido formado, sin embargo, puede ser una fase menos estable llamada aragonita, que tiene la misma fórmula química que, pero una estructura cristalina diferente a la de la calcita.
La lluvia disuelve el carbonato de calcio por las dos reacciones mostradas anteriormente. El agua lleva los iones con ella, sorbe a través de la grieta de las rocas. Cuando llegó al techo de una cueva, la gota colgaba ahí por mucho tiempo antes de caer. Durante este tiempo, el dióxido de carbono escapa y el pH del agua aumenta. Comienzan a aparecer cristales de carbonato de calcio. La calcita, la aragonita, la estalactita y la estalagmita son cuatro sólidos comunes que se encuentran en la formación de cuevas.
Minerales disueltos
En la tabla se\(\PageIndex{1}\) enumeran los principales iones presentes en el agua de mar. La composición varía dependiendo de la región, profundidad, latitud y temperatura del agua. Las aguas de las desembocaduras de los ríos contienen menos sal. Si los iones son utilizados por organismos vivos, su contenido varía según las poblaciones de organismos.
Las partículas de polvo y los iones presentes en el aire son el centro de nucleación de las gotas de agua. Así, las aguas de lluvia y nieve también contienen tales iones: Ca 2+, Mg 2+, Na +, K +, NH 4 +. Estos cationes están equilibrados por aniones, HCO 3 -, SO 4 -, NO 2 -, Cl -, y NO 3 -. El pH de la lluvia está entre 5.5 y 5.6. Las aguas de lluvia y nieve eventualmente se convierten en aguas de ríos o lagos. Cuando caen las aguas de lluvia o nieve, interactúan con la vegetación, el suelo superior, la roca del lecho, el lecho del río y el lecho del lago, disolviendo lo que sea soluble. Las bacterias, las algas y los insectos acuáticos también prosperan. Las solubilidades de las sales inorgánicas se rigen por la cinética y los equilibrios de disolución. Los iones más comunes en las aguas lacustres y fluviales son los mismos que los presentes en el agua de lluvia, pero a mayores concentraciones. El pH de estas aguas depende del lecho del río y del lecho del lago. Las aguas naturales contienen minerales disueltos. Las aguas que contienen iones Ca 2+ y Mg 2+ generalmente se llaman agua dura.
|
cationes
|
g/kg
|
aniones
|
g/kg
|
|---|---|---|---|
| Na + |
10.77
|
Cl — |
19.354
|
| Mg 2 + |
1.29
|
SO 4 2— |
2.712
|
| Ca 2 + |
0.412
|
Br — |
0.087
|
| K + |
0.399
|
||
| Sr 2 + |
0.0079
|
||
| Al 3 + |
0.005
|
Aunque la mayoría de los elementos se encuentran en el agua de mar solo a niveles traza, los organismos marinos pueden absorberlos selectivamente y hacerlos más detectables. El yodo, por ejemplo, fue descubierto en algas marinas (algas marinas) 14 años antes de que se encontrara en el agua de mar. Otros elementos que no se detectaron en el agua de mar hasta después de ser encontrados en organismos marinos incluyen bario, cobalto, cobre, plomo, níquel, plata y zinc. Si-32, presumiblemente derivado del bombardeo de rayos cósmicos de Ar, ha sido descubierto en esponjas marinas.
Agua Dura
Los minerales generalmente se disuelven en cuerpos de agua naturales como lagos, ríos, manantiales y vías fluviales subterráneas (aguas subterráneas). El carbonato de calcio, CaCo 3, es uno de los compuestos inorgánicos más comunes en la corteza terrestre. Es el ingrediente tanto para la calcita como para la aragonita. Estos dos minerales tienen diferentes estructuras cristalinas y apariencia. Esta fotografía muestra cristales de Calcita típica.
Los minerales de carbonato de calcio se disuelven en agua, con un producto de solubilidad como se muestra a continuación.
\[CaCO_3 \rightleftharpoons Ca^{2+} + CO_3^{2-} \;\;\; K_{sp} = 5 \times 10^{-9} \nonumber \]
A partir del producto de solubilidad, podemos (ver ejemplo 1) evaluar la solubilidad molar para que sea 7.1x10 -5 M o 7.1 mg/L (7.1 ppm de CaCo 3 en agua). La solubilidad aumenta a medida que el pH disminuye (aumenta la acidez). Esto se agrava cuando el agua está saturada con dióxido de carbono, CO 2. La solución saturada de CO 2 contiene ácido carbónico, que ayudan a la disolución debido a la reacción:
\[H_2O + CO_2 \rightleftharpoons H_2CO_3 \nonumber \]
\[CaCO_3 + H_2CO_3 \rightleftharpoons Ca^{2+} + 2 HCO_3^- \nonumber \]
Debido a estas reacciones, algunas aguas naturales contienen más de 300 ppm de carbonatos de calcio o sus equivalentes.
La composición del océano ha atraído la atención de algunos de los nombres más famosos de la ciencia, entre ellos Robert Boyle, Antoine Lavoisier y Edmund Halley. Sus primeras investigaciones tendían a ser difíciles de reproducir, debido a las diferentes condiciones en las que cristalizaban las diversas sales. Se pueden obtener hasta 54 sales, sales dobles y sales hidratadas evaporando el agua de mar a sequedad. Actualmente se sabe que al menos 73 elementos están presentes en el agua de mar.
Materia Orgánica
La mayor parte del carbono orgánico en el agua de mar está presente como material disuelto, con solo alrededor del 1-2% en partículas. El contenido total de carbono orgánico oscila entre 0.5 mg/L en aguas profundas y 1.5 mg/L cerca de la superficie. Todavía hay un desacuerdo considerable sobre la composición de la materia orgánica disuelta; gran parte de ella parece ser de alto peso molecular, y puede ser polimérica. Se pueden aislar sustancias cualitativamente similares a los ácidos húmicos que se encuentran en los suelos. El color verdoso que a menudo se asocia con las aguas costeras se debe a una mezcla de sustancias fluorescentes de alto peso molecular de composición indeterminada conocida como “Gelbstoffe”. Es probable que la significación de la fracción orgánica del agua de mar pueda ser mucho mayor de lo que sugiere su baja abundancia. Por un lado, muchas de estas sustancias son similares a lípidos y tienden a adsorberse en las superficies. Se ha demostrado que cualquier partícula que ingresa al océano se recubre rápidamente con una película superficial orgánica que puede influir en la velocidad y extensión de su disolución o descomposición. Ciertos iones inorgánicos pueden estar fuertemente complejados por sustancias de tipo húmico. La superficie del océano está cubierta principalmente con una película orgánica, de solo unas pocas capas moleculares de espesor. Se cree que esto consiste en hidrocarburos, lípidos y similares, pero se han reportado glicoproteínas y proteoglicanos. Si esta película se retira cuidadosamente de un recipiente de agua de mar, se reconstituirá rápidamente. Se desconoce cuán significativa es esta película en sus efectos sobre el intercambio de gases con la atmósfera.
Resumen
- El ciclo del agua (hidrológico) describe el movimiento continuo del agua sobre, por encima y por debajo de la superficie de la Tierra. El agua se mueve de un reservorio a otro, como de río a océano, o del océano a la atmósfera, por los procesos físicos de evaporación, condensación, precipitación, infiltración, escorrentía superficial y flujo subsuperficial. Al hacerlo, el agua pasa por diferentes formas: líquida, sólida (hielo) y capor.
- Las diferentes sustancias que se pueden encontrar en las aguas naturales incluyen minerales disueltos, gases disueltos y materia orgánica.
Colaboradores y Atribuciones
- Template:ContribCandelaGeo
- TextMap: Introduction to Environmental Science (Zendher et al.)
Chung (Peter) Chieh (Chemistry, University of Waterloo)
Stephen Lower, Professor Emeritus (Simon Fraser U.) Chem1 Virtual Textbook

