1.4: ¿Por qué es especial la química orgánica?
- Page ID
- 73597
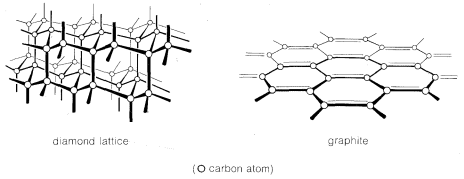
Consideremos algunos de los factores que hacen que gran parte de la química se centren en un solo elemento, el carbono. Una característica muy importante es que los enlaces carbono-carbono son fuertes, por lo que son posibles cadenas largas o anillos de átomos de carbono unidos entre sí. El diamante y el grafito son dos ejemplos familiares, siendo la red de diamante una red tridimensional de átomos de carbono, mientras que el grafito en realidad se parece más a una red plana. Las propiedades lubricantes del grafito en realidad están relacionadas con su estructura, lo que permite que los planos se deslicen uno más allá del otro.
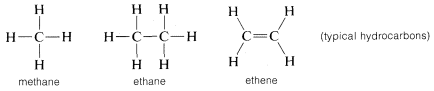
Pero el carbono no es único en la formación de enlaces consigo mismo porque otros elementos como el boro, el silicio y el fósforo forman enlaces fuertes en el estado elemental. La singularidad del carbono se deriva más del hecho de que forma fuertes enlaces carbono-carbono que también son fuertes cuando se combina con otros elementos. Por ejemplo, la combinación de hidrógeno con carbono proporciona una notable variedad de hidruros de carbono, o hidrocarburos como se les suele llamar. En contraste, ninguno de los otros elementos de la segunda fila excepto el boro da un sistema muy extenso de hidruros estables, y la mayoría de los hidruros de boro son mucho más reactivos que los hidrocarburos, especialmente al agua y al aire.
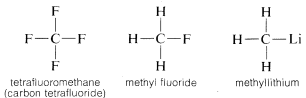
El carbono forma enlaces no solo consigo mismo y con hidrógeno sino también con muchos otros elementos, incluidos elementos fuertemente atrayentes de electrones como el flúor y metales fuertemente electropositivos como el litio:
¿Por qué el carbono es tan versátil en su capacidad de unión a muy diferentes tipos de elementos? Las propiedades especiales del carbono pueden atribuirse a que es un átomo relativamente pequeño con cuatro electrones de valencia. Para formar compuestos simples similares a sales como el cloruro de sodio\(Na^\oplus Cl^\ominus\), el carbono tendría que perder los cuatro electrones de valencia a un elemento como el flúor y convertirse en un ion cuadripositivo\(C^{4 \oplus}\), o adquirir cuatro electrones de un elemento como el litio y formar un ion cuadrinegativo, \(C^{4 \ominus}\). La ganancia de cuatro electrones sería energéticamente muy desfavorable debido a la repulsión mutua entre los electrones.
Habitualmente, el carbono completa su octeto de valencia-concha compartiendo electrones con otros átomos. En compuestos con enlaces electrónicos compartidos (o enlaces covalentes) tales como metano, etano o tetrafluorometano, cada uno de los átomos unidos, incluido el carbono, tiene su envoltura de valencia llena, como se muestra en las siguientes\(^6\) estructuras de pares de electrones o de Lewis:
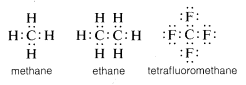
De esta manera, las repulsiones entre electrones asociadas con la terminación de la capa de valencia del carbono son compensadas por las potencias de atracción de electrones de los núcleos cargados positivamente de los átomos a los que está unido el carbono.
Sin embargo, los electrones de un enlace covalente no son necesariamente compartidos por igual por los átomos unidos, especialmente cuando las afinidades de los átomos por los electrones son muy diferentes. Así, los enlaces carbono-flúor y carbono-litio, aunque no son iónicos, están polarizados de tal manera que los electrones se asocian más con el átomo de mayor afinidad electrónica. Este suele ser el átomo con la mayor carga nuclear efectiva.
\(\overset{\delta \oplus}{C} \: \: \: \: \: : \overset{\delta \ominus}{F} \: \: \: \: \: \: \: \: \: \: \: \: \: \: \: \: \overset{\delta \ominus}{C:} \: \: \: \: \: \overset{\delta \oplus}{Li} \: \: \: \: \: \: \: \: \: \: \: \: \: \: \: \scriptsize{\left( \delta \oplus, \: \delta \ominus \: \text{denote partial ionic bonds} \right)}\)
Vemos entonces una gradación de enlaces puramente iónicos a puramente covalentes en diferentes moléculas, y esto se manifiesta en sus propiedades químicas y físicas. Consideremos, por ejemplo, los hidruros de los elementos en la segunda fila horizontal de la tabla periódica. Sus puntos de fusión y ebullición,\(^7\) donde se conocen, se dan a continuación.
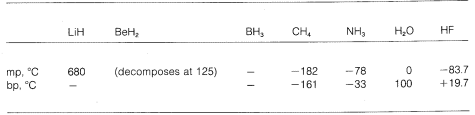
El hidruro de litio se puede considerar como un compuesto iónico similar a la sal,\(\overset{\oplus}{Li} \: \: \: : \overset{\ominus}{H}\). Las atracciones electrostáticas entre los iones cargados opuestamente en la red cristalina son fuertes, lo que hace que el hidruro de litio sea un sólido no volátil de alto punto de fusión como cloruro de sodio, fluoruro de litio, etc.
El metano\(CH_4\),, está en el otro extremo. Se hierve a\(-161^\text{o}\), que es aproximadamente\(800^\text{o}\) menor incluso que el punto de fusión del hidruro de litio. Debido a que el carbono y el hidrógeno tienen aproximadamente el mismo poder de atracción de electrones,\(C-H\) los enlaces tienen poco carácter iónico y el metano puede caracterizarse como una sustancia no polar. Como resultado, hay relativamente poca atracción electrostática entre las moléculas de metano y esto les permite “escapar” más fácilmente entre sí como moléculas gaseosas, de ahí el bajo punto de ebullición.
El fluoruro de hidrógeno tiene un punto de ebullición algo\(200^\text{o}\) mayor que el del metano. El par de electrones de enlace\(HF\) se dibuja más hacia el flúor que hacia el hidrógeno, por lo que el enlace puede formularse como\(\overset{\delta \oplus}{H}\) -\(\overset{\delta \ominus}{F}\). En el fluoruro de hidrógeno líquido, las moléculas tienden a agregarse a través de lo que se llama enlaces de hidrógeno en cadenas y anillos dispuestos de manera que el hidrógeno positivo en una molécula atrae un flúor negativo en la siguiente:
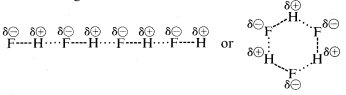
Cuando se vaporiza el fluoruro de hidrógeno líquido, la temperatura debe elevarse lo suficiente para superar estas atracciones electrostáticas intermoleculares; de ahí que el punto de ebullición sea alto en comparación con el metano líquido. El fluoruro de hidrógeno se caracteriza mejor como una sustancia polar, pero no iónica. Aunque los\(N-H\) enlaces\(O-H\) y del agua y el amoníaco tienen un carácter algo menos iónico que los\(H-F\) enlaces del fluoruro de hidrógeno, estas sustancias también son de naturaleza relativamente polar y también se asocian a través de enlaces de hidrógeno de la misma manera que el fluoruro de hidrógeno.
Las propiedades químicas del hidruro de litio, metano y fluoruro de hidrógeno están de acuerdo con las formulaciones anteriores. Así, cuando se rompe el enlace con el hidrógeno, podríamos esperar que se rompa en el sentido\(\begin{array}{c:c} Li^\oplus & :H^\ominus \end{array}\) para hidruro de litio, y\(\begin{array}{c:c} \overset{\delta \oplus}{H} & : \underset{\cdot \cdot}{\ddot{F}}:^{\delta \ominus} \end{array}\) para fluoruro de hidrógeno para que el par de electrones vaya con el átomo de mayor afinidad electrónica. Este es efectivamente el caso como indica la siguiente reacción:
\(\begin{array}{c:c} Li^\oplus & :H^\ominus \end{array} + \begin{array}{c:c} H & : \underset{\cdot \cdot}{\ddot{F}} : \end{array} \longrightarrow Li^\oplus : \underset{\cdot \cdot}{\ddot{F}}:^\oplus + \: H : H\)
El metano, con sus enlaces relativamente no polares, es inerte a casi todos los reactivos que podrían eliminar el hidrógeno como\(H^\oplus\) o\(H:^\ominus\) excepto bajo cualquier cosa que no sea condiciones extremas. Como era de esperar, los cationes metilo\(CH_3^\oplus\) y los aniones metílicos\(CH_3:^\ominus\) son muy difíciles de generar y son extremadamente reactivos. Por esta razón, no se observan las siguientes reacciones:
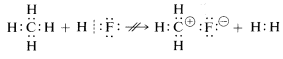
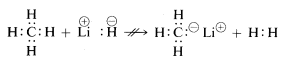
De lo anterior se puede anticipar que la química de los compuestos de carbono será en gran parte la química de los compuestos covalentes y no se parecerá en absoluto a la química de las sales inorgánicas como el cloruro de sodio. También puede anticipar que las principales diferencias en las propiedades químicas y físicas de los compuestos orgánicos surgirán de la naturaleza de los otros elementos unidos al carbono. Por lo tanto, no se espera que el metano tenga, ni tenga, la misma química que otros compuestos de un carbono como el metillitio\(CH_3Li\), o el fluoruro de metilo,\(CH_3F\).
\(^6\)G. N. Lewis (1876-1946), el renombrado químico estadounidense, fue el primero en comprender la importancia del par de electrones en la estructura molecular. En su tratado sobre Valencia y la Estructura de Átomos y Moléculas (1923) sentó las bases de la teoría moderna de la estructura y la vinculación.
\(^7\)A lo largo de este texto todas las temperaturas no designadas de otra manera deben entenderse como en\(^\text{o}C\); las temperaturas absolutas se mostrarán como\(^\text{o}K\).
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


