2.1: Fórmulas estructurales
- Page ID
- 72492
El componente básico de la química orgánica estructural es el átomo de carbono tetravalente. Con pocas excepciones, los compuestos de carbono pueden formularse con cuatro enlaces covalentes a cada carbono, independientemente de si la combinación es con carbono o algún otro elemento. El enlace de dos electrones, que se ilustra por los enlaces carbono-hidrógeno en metano o etano y el enlace carbono-carbono en etano, se denomina enlace sencillo. En estas y muchas sustancias relacionadas, cada carbono está unido a otros cuatro átomos:
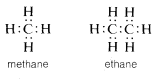
Existen, sin embargo, compuestos como el eteno (etileno)\(C_2H_4\), en los que dos electrones de cada uno de los átomos de carbono se comparten mutuamente, produciendo así dos enlaces de dos electrones, una disposición que se denomina doble enlace. Cada carbono en eteno está unido a solo otros tres átomos:
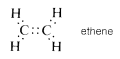
De igual manera, en el etino (acetileno)\(C_2H_2\), tres electrones de cada átomo de carbono se comparten mutuamente, produciendo tres enlaces de dos electrones, llamados triple enlace, en el que cada carbono está unido a solo otros dos átomos:
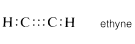
Por supuesto, en todos los casos cada carbono tiene un octeto completo de electrones. El carbono también forma enlaces dobles y triples con varios otros elementos que pueden exhibir una covalencia de dos o tres. El doble enlace carbono-oxígeno (o carbonilo) aparece en el dióxido de carbono y muchos compuestos orgánicos importantes como el metanal (formaldehído) y el ácido etanoico (ácido acético). De manera similar, aparece un triple enlace carbono-nitrógeno en metanonitrilo (cianuro de hidrógeno) y etanonitrilo (acetonitrilo).
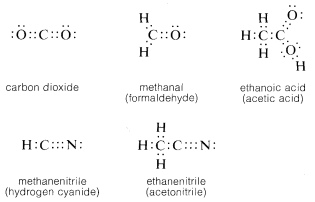
Por convención, una sola línea recta que conecta los símbolos atómicos se usa para representar un enlace simple (de dos electrones), dos de esas líneas para representar un enlace doble (cuatro electrones) y tres líneas un enlace triple (seis electrones). Las representaciones de compuestos por estos símbolos se denominan fórmulas estructurales; algunos ejemplos son
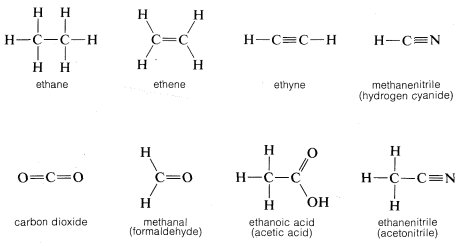
Un punto que vale la pena señalar es que las fórmulas estructurales generalmente no indican los pares de electrones no enlazantes. Esto quizás sea desafortunado porque juegan tanto papel en la química de las moléculas orgánicas como lo hacen los electrones de unión y su omisión puede llevar al lector incautos a pasarlos por alto. Sin embargo, cuando es importante representarlos, esto se puede hacer mejor con pares de puntos, aunque algunos autores utilizan líneas:
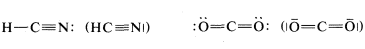
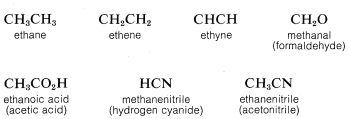
Para ahorrar espacio y tiempo en la representación de estructuras orgánicas, es una práctica común utilizar “fórmulas condensadas” en las que los enlaces no se muestran explícitamente. Al usar fórmulas condensadas, las valencias atómicas normales se entienden en todo momento. Ejemplos de fórmulas condensadas son
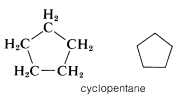
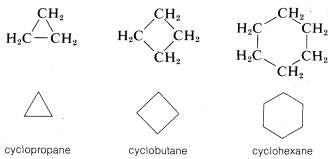
Otro tipo de abreviatura que a menudo se usa, particularmente para compuestos de anillo, prescinde de los símbolos para átomos de carbono e hidrógeno y deja solo las líneas en una fórmula estructural. Por ejemplo, el ciclopentano\(C_5H_{10}\), a menudo se representa como un pentágono regular en el que se entiende que cada ápice representa un átomo de carbono con el número requerido de hidrógenos para satisfacer la tetravalencia del carbono:
Asimismo, ciclopropano,\(C_3H_6\) ciclobutano,\(C_4H_8\) y ciclohexano\(C_6H_{12}\), se dibujan como polígonos regulares:
Aunque este tipo de dibujo lineal se emplea más comúnmente para estructuras cíclicas, su uso para estructuras de cadena abierta (acíclicas) se está extendiendo cada vez más. No hay mérito especial en esta abreviatura para estructuras simples como butano,\(C_4H_{10}\); 1-buteno\(C_4H_8\); o 1,3-butadieno\(C_4H_6\), pero es de valor en la representación de moléculas más complejas como\(\beta\) -caroteno,\(C_{40}H_{56}\):
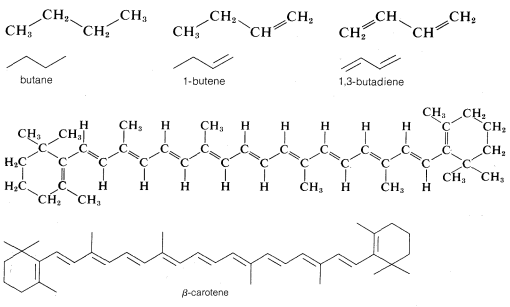
Las estructuras lineales también pueden modificarse para representar las formas tridimensionales de las moléculas, y la forma en que esto se hace se discutirá en detalle en el Capítulo 5. Al inicio de tu estudio de química orgánica, debes escribir las fórmulas de manera bastante completa hasta que estés completamente familiarizado con lo que significan estas abreviaturas.
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


